Pengertian basa menurut bronsted-lowry adalah – Pernah dengar istilah asam dan basa? Nah, dalam dunia kimia, ada teori yang mencoba menjelaskan sifat asam dan basa dengan cara yang lebih luas. Salah satunya adalah teori Brønsted-Lowry, yang menyatakan bahwa basa adalah zat yang bisa menerima proton. Apa itu proton? Proton adalah partikel bermuatan positif yang ada di dalam inti atom. Jadi, basa dalam teori ini seperti ‘penangkap’ proton, yang siap menerima si proton untuk membentuk senyawa baru.
Teori Brønsted-Lowry ini muncul karena teori asam-basa Arrhenius yang sebelumnya hanya berlaku untuk zat yang terlarut dalam air. Teori Brønsted-Lowry lebih fleksibel karena bisa menjelaskan reaksi asam-basa dalam berbagai pelarut. Misalnya, reaksi asam-basa yang terjadi dalam larutan organik, seperti metanol atau aseton.
Sejarah Teori Brønsted-Lowry
Teori Brønsted-Lowry, yang dicetuskan oleh kimiawan Denmark Johannes Nicolaus Brønsted dan kimiawan Inggris Thomas Martin Lowry pada tahun 1923, merupakan teori asam-basa yang memberikan pemahaman yang lebih luas tentang reaksi asam-basa. Teori ini menawarkan perspektif yang berbeda dengan teori Arrhenius, yang hanya fokus pada reaksi asam-basa dalam larutan air.
Latar Belakang Munculnya Teori Brønsted-Lowry
Teori Arrhenius, yang diperkenalkan pada tahun 1884, mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan air, dan basa sebagai zat yang menghasilkan ion hidroksida (OH–) dalam larutan air. Namun, teori ini memiliki keterbatasan dalam menjelaskan reaksi asam-basa yang terjadi di luar larutan air, seperti reaksi yang melibatkan amonia (NH3) sebagai basa.
Brønsted dan Lowry secara independen menyadari bahwa definisi asam-basa dapat diperluas untuk mencakup reaksi yang melibatkan transfer proton (H+) tanpa perlu melibatkan air. Mereka mendefinisikan asam sebagai zat yang dapat mendonorkan proton, dan basa sebagai zat yang dapat menerima proton.
Perbedaan Teori Brønsted-Lowry dengan Teori Arrhenius
Perbedaan utama antara teori Brønsted-Lowry dan teori Arrhenius terletak pada definisi asam dan basa. Teori Arrhenius hanya berlaku dalam larutan air, sedangkan teori Brønsted-Lowry memiliki cakupan yang lebih luas, meliputi reaksi asam-basa di berbagai pelarut dan bahkan dalam fase gas.
- Teori Arrhenius: Asam menghasilkan H+ dalam air, basa menghasilkan OH– dalam air.
- Teori Brønsted-Lowry: Asam adalah donor proton (H+), basa adalah akseptor proton (H+).
Contoh Reaksi Asam-Basa Menurut Teori Brønsted-Lowry
Berikut adalah contoh reaksi asam-basa yang sesuai dengan teori Brønsted-Lowry:
HCl (g) + NH3 (g) → NH4+ (g) + Cl– (g)
Dalam reaksi ini, HCl bertindak sebagai asam karena mendonorkan proton (H+) kepada NH3, yang bertindak sebagai basa karena menerima proton. Hasilnya adalah pembentukan ion amonium (NH4+) dan ion klorida (Cl–).
Konsep Proton Transfer
Teori Brønsted-Lowry menjelaskan asam dan basa berdasarkan kemampuan mereka untuk menerima atau melepaskan proton (ion hidrogen, H+). Inti dari teori ini adalah transfer proton, yang merupakan kunci untuk memahami reaksi asam-basa.
Transfer Proton dalam Reaksi Asam-Basa
Dalam teori Brønsted-Lowry, asam didefinisikan sebagai spesies kimia yang dapat melepaskan proton (H+), sedangkan basa adalah spesies kimia yang dapat menerima proton (H+). Transfer proton terjadi ketika asam bereaksi dengan basa, menghasilkan asam konjugat dan basa konjugat.
Contoh Reaksi Transfer Proton
Sebagai contoh, perhatikan reaksi antara asam klorida (HCl) dengan air (H2O):
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)
Dalam reaksi ini, asam klorida (HCl) melepaskan proton (H+) dan menjadi ion klorida (Cl-), yang merupakan basa konjugat dari HCl. Air (H2O) menerima proton (H+) dan menjadi ion hidronium (H3O+), yang merupakan asam konjugat dari H2O.
Identifikasi Asam dan Basa Konjugat
Setiap reaksi asam-basa melibatkan pasangan asam-basa konjugat. Asam konjugat adalah spesies yang terbentuk ketika basa menerima proton, sedangkan basa konjugat adalah spesies yang terbentuk ketika asam melepaskan proton. Dalam contoh sebelumnya:
- HCl adalah asam, dan Cl- adalah basa konjugatnya.
- H2O adalah basa, dan H3O+ adalah asam konjugatnya.
Penting untuk memahami bahwa asam konjugat dan basa konjugat selalu berada dalam kesetimbangan. Dalam contoh reaksi di atas, ion hidronium (H3O+) dapat melepaskan proton kembali ke ion klorida (Cl-), menghasilkan kembali asam klorida (HCl) dan air (H2O).
Asam dan Basa Konjugat
Teori Brønsted-Lowry memandang asam dan basa sebagai donor dan akseptor proton. Dalam konsep ini, ada pasangan yang disebut asam dan basa konjugat. Jadi, kamu bakal menemukan bahwa setiap asam punya pasangan basa konjugat, dan setiap basa juga punya pasangan asam konjugat. Yuk, kita bahas lebih lanjut!
Pengertian Asam dan Basa Konjugat
Dalam teori Brønsted-Lowry, asam konjugat adalah spesies yang terbentuk ketika basa menerima proton (H+). Sementara basa konjugat adalah spesies yang terbentuk ketika asam melepaskan proton.
Jadi, gini nih ilustrasinya:
Asam + Basa ⇌ Basa Konjugat + Asam Konjugat
Pasangan asam-basa konjugat ini selalu berdampingan dalam reaksi asam-basa. Asam dan basa konjugat memiliki rumus kimia yang sama, hanya saja beda satu proton (H+).
Contoh Pasangan Asam-Basa Konjugat
Contohnya, nih:
- Ketika HCl (asam klorida) dilarutkan dalam air (H2O), HCl akan melepaskan proton (H+) dan membentuk ion klorida (Cl-). Air akan menerima proton tersebut dan menjadi ion hidronium (H3O+).
Nah, dalam reaksi ini:
- HCl adalah asam, dan Cl- adalah basa konjugatnya.
- H2O adalah basa, dan H3O+ adalah asam konjugatnya.
Tabel Pasangan Asam-Basa Konjugat
Nih, beberapa contoh pasangan asam-basa konjugat beserta rumus kimianya:
| Asam | Basa Konjugat | Rumus Kimia |
|---|---|---|
| HCl (asam klorida) | Cl- (ion klorida) | HCl ⇌ H+ + Cl- |
| H2SO4 (asam sulfat) | HSO4- (ion hidrogen sulfat) | H2SO4 ⇌ H+ + HSO4- |
| HNO3 (asam nitrat) | NO3- (ion nitrat) | HNO3 ⇌ H+ + NO3- |
| H2O (air) | OH- (ion hidroksida) | H2O ⇌ H+ + OH- |
| NH4+ (ion amonium) | NH3 (amonia) | NH4+ ⇌ H+ + NH3 |
Kekuatan Asam dan Basa
Oke, kita udah bahas teori Brønsted-Lowry, sekarang kita bahas yang lebih menarik: kekuatan asam dan basa! Kayak gimana sih kita ngukur seberapa kuat asam atau basa itu? Simak terus ya, penjelasannya seru nih.
Nah, dalam teori Brønsted-Lowry, kekuatan asam dan basa diukur berdasarkan kemampuannya untuk melepaskan atau menerima proton (H+). Makin mudah suatu asam melepaskan proton, makin kuat asamnya. Begitu juga dengan basa, makin mudah menerima proton, makin kuat basanya.
Faktor-Faktor yang Mempengaruhi Kekuatan Asam dan Basa
Kekuatan asam dan basa gak cuma dipengaruhi oleh kemampuan melepaskan atau menerima proton, tapi juga faktor-faktor lain, nih:
- Ikatan Kimia: Ikatan kimia dalam asam atau basa bisa mempengaruhi kekuatannya. Ikatan yang lemah lebih mudah putus, sehingga melepaskan proton lebih mudah.
- Struktur Molekul: Struktur molekul asam atau basa juga berpengaruh. Misalnya, asam karboksilat (COOH) lebih kuat daripada alkohol (OH) karena gugus karboksil lebih elektronegatif dan menarik elektron lebih kuat, sehingga melepaskan proton lebih mudah.
- Efek Induktif: Efek induktif adalah pengaruh gugus atom lain pada ikatan kimia. Gugus yang menarik elektron akan memperkuat asam, sedangkan gugus yang menolak elektron akan memperlemahnya.
- Efek Resonansi: Efek resonansi terjadi ketika elektron bisa berpindah antar atom dalam molekul. Efek ini bisa memperkuat atau melemahkan asam, tergantung pada strukturnya.
- Pelarut: Pelarut juga bisa mempengaruhi kekuatan asam dan basa. Asam atau basa akan lebih kuat dalam pelarut polar daripada pelarut nonpolar.
Contoh Asam Kuat, Asam Lemah, Basa Kuat, dan Basa Lemah
Nah, sekarang kita lihat contoh-contohnya. Siap-siap, nih:
| Jenis | Contoh | Keterangan |
|---|---|---|
| Asam Kuat | HCl (Asam Klorida), HBr (Asam Bromida), HI (Asam Iodida), HNO3 (Asam Nitrat), H2SO4 (Asam Sulfat) | Asam kuat melepaskan proton (H+) hampir seluruhnya dalam larutan. |
| Asam Lemah | CH3COOH (Asam Asetat), H2CO3 (Asam Karbonat), H3PO4 (Asam Fosfat) | Asam lemah hanya melepaskan sebagian protonnya dalam larutan. |
| Basa Kuat | NaOH (Natrium Hidroksida), KOH (Kalium Hidroksida), LiOH (Litium Hidroksida), Ca(OH)2 (Kalsium Hidroksida) | Basa kuat menerima proton (H+) hampir seluruhnya dalam larutan. |
| Basa Lemah | NH3 (Amonia), CH3NH2 (Metilamina), C6H5NH2 (Anilina) | Basa lemah hanya menerima sebagian protonnya dalam larutan. |
Reaksi Asam-Basa dalam Larutan
Oke, guys, kita udah bahas definisi asam dan basa menurut Brønsted-Lowry. Sekarang, kita mau ngebahas gimana teori ini ngejelasin reaksi asam-basa di larutan. Biar makin ngerti, kita juga bakal ngasih contoh reaksi dan ngejelasin asam dan basa konjugatnya. Siap-siap deh, kita bakal bahas juga reaksi netralisasi!
Teori Brønsted-Lowry dalam Reaksi Asam-Basa
Teori Brønsted-Lowry ngejelasin reaksi asam-basa sebagai proses transfer proton (H+). Jadi, asam adalah zat yang bisa ngelepas proton, sedangkan basa adalah zat yang bisa menerima proton. Gampang kan?
Nah, dalam reaksi asam-basa, asam ngelepas proton dan jadi basa konjugatnya, sedangkan basa menerima proton dan jadi asam konjugatnya.
Contoh Reaksi Asam-Basa
Yuk, kita lihat contohnya. Misal, kita punya reaksi antara asam klorida (HCl) dan air (H2O):
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)
Dalam reaksi ini, HCl ngelepas proton (H+) dan jadi ion klorida (Cl-), yang merupakan basa konjugatnya. Air menerima proton dan jadi ion hidronium (H3O+), yang merupakan asam konjugatnya.
Reaksi Netralisasi Asam-Basa
Reaksi netralisasi adalah reaksi antara asam dan basa yang menghasilkan garam dan air. Nah, teori Brønsted-Lowry bisa ngejelasin reaksi ini dengan baik. Misal, reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH):
HCl(aq) + NaOH(aq) ⇌ NaCl(aq) + H2O(l)
Dalam reaksi ini, HCl ngelepas proton dan jadi ion klorida (Cl-), sedangkan NaOH menerima proton dan jadi ion hidroksida (OH-). Ion klorida dan ion hidroksida kemudian bereaksi membentuk garam natrium klorida (NaCl) dan air (H2O).
Penerapan Teori Brønsted-Lowry
Teori Brønsted-Lowry, yang membahas tentang asam dan basa berdasarkan kemampuan mereka untuk menyumbangkan atau menerima proton (ion hidrogen, H+), merupakan konsep fundamental dalam kimia. Teori ini punya pengaruh besar dalam memahami berbagai reaksi kimia dan menjelaskan sifat-sifat zat di sekitar kita.
Penerapan Teori Brønsted-Lowry dalam Bidang Kimia
Teori Brønsted-Lowry membuka jalan untuk memahami reaksi asam-basa dengan lebih mendalam. Penerapannya meluas dalam berbagai bidang kimia, seperti:
- Kimia Anorganik: Teori ini membantu dalam memahami reaksi asam-basa dalam larutan anorganik, seperti reaksi antara asam kuat dan basa kuat, pembentukan garam, dan reaksi hidrolisis.
- Kimia Organik: Teori Brønsted-Lowry menjadi dasar dalam mempelajari reaksi asam-basa dalam kimia organik, seperti reaksi adisi, substitusi, dan eliminasi.
- Kimia Analitik: Teori ini membantu dalam pengembangan metode titrasi asam-basa, yang digunakan untuk menentukan konsentrasi zat terlarut.
- Kimia Fisika: Teori Brønsted-Lowry digunakan untuk mempelajari kinetika dan termodinamika reaksi asam-basa, serta untuk memahami sifat-sifat larutan asam-basa.
Cara Teori Brønsted-Lowry Membantu Memahami Reaksi Kimia
Teori Brønsted-Lowry membantu kita memahami reaksi kimia dengan cara berikut:
- Mengidentifikasi Asam dan Basa: Teori ini memberikan definisi yang jelas tentang asam dan basa berdasarkan kemampuan mereka untuk menyumbangkan atau menerima proton.
- Mempelajari Reaksi Transfer Proton: Teori Brønsted-Lowry menjelaskan bahwa reaksi asam-basa melibatkan transfer proton dari asam ke basa.
- Memahami Konsep Konjugasi: Teori ini memperkenalkan konsep asam konjugat dan basa konjugat, yang merupakan pasangan asam-basa yang saling terkait.
- Menjelaskan Kekuatan Asam dan Basa: Teori Brønsted-Lowry membantu dalam memahami faktor-faktor yang menentukan kekuatan asam dan basa, seperti struktur molekul dan efek induksi.
Contoh Aplikasi Teori Brønsted-Lowry dalam Kehidupan Sehari-hari
Teori Brønsted-Lowry tidak hanya berlaku di laboratorium, tetapi juga punya peran penting dalam kehidupan sehari-hari. Berikut contohnya:
- Pencernaan Makanan: Asam lambung (HCl) membantu memecah makanan, sementara basa dalam usus kecil menetralkan asam lambung.
- Penggunaan Antasida: Antasida, seperti magnesium hidroksida (Mg(OH)2), digunakan untuk menetralkan asam lambung berlebih.
- Penggunaan Sabun dan Detergen: Sabun dan detergen mengandung basa yang membantu membersihkan kotoran dengan cara melepaskan lemak dan minyak dari permukaan.
- Pengolahan Air: Teori Brønsted-Lowry digunakan untuk mengatur pH air minum dan air kolam renang.
Kekurangan Teori Brønsted-Lowry
Teori Brønsted-Lowry, yang menjelaskan asam dan basa berdasarkan kemampuan mereka untuk menerima atau melepaskan proton, merupakan konsep fundamental dalam kimia. Namun, seperti teori ilmiah lainnya, teori Brønsted-Lowry juga memiliki keterbatasan. Ada beberapa reaksi yang tidak dapat dijelaskan secara tuntas oleh teori ini, dan beberapa contoh reaksi asam-basa di luar lingkup teori Brønsted-Lowry.
Dalam kimia, basa menurut Bronsted-Lowry adalah zat yang menerima proton (H+). Konsep ini mirip dengan bagaimana kita memahami pengertian penjaskes menurut para ahli, yang mana fokusnya pada pengembangan kemampuan fisik, motorik, dan kognitif seseorang. Sama seperti basa menerima proton untuk membentuk asam konjugat, penjaskes juga menerima masukan dari berbagai ahli untuk membangun fondasi pembelajaran yang kokoh.
Jadi, baik basa dalam kimia maupun penjaskes dalam pendidikan, keduanya berfokus pada penerimaan dan pengembangan, yang akhirnya menghasilkan hasil yang lebih optimal.
Reaksi Asam-Basa yang Tidak Dapat Dijelaskan oleh Teori Brønsted-Lowry
Teori Brønsted-Lowry berfokus pada transfer proton (H+) sebagai definisi utama asam dan basa. Namun, beberapa reaksi kimia tidak melibatkan transfer proton dan tetap menunjukkan sifat asam-basa. Contohnya, reaksi antara trimetilamina (N(CH3)3) dan boron trifluorida (BF3):
N(CH3)3 + BF3 → N(CH3)3BF3
Dalam reaksi ini, trimetilamina bertindak sebagai basa karena menyumbangkan pasangan elektron bebas ke boron trifluorida, yang bertindak sebagai asam. Reaksi ini tidak melibatkan transfer proton, sehingga tidak dapat dijelaskan oleh teori Brønsted-Lowry.
Teori Asam-Basa Lainnya
Untuk mengatasi keterbatasan teori Brønsted-Lowry, beberapa teori asam-basa lainnya telah dikembangkan, termasuk:
- Teori Lewis: Teori ini mendefinisikan asam sebagai spesies yang menerima pasangan elektron dan basa sebagai spesies yang menyumbangkan pasangan elektron. Teori Lewis dapat menjelaskan reaksi asam-basa yang tidak melibatkan transfer proton, seperti reaksi antara trimetilamina dan boron trifluorida yang disebutkan sebelumnya.
- Teori Usanovich: Teori ini memberikan definisi yang lebih luas tentang asam dan basa. Asam didefinisikan sebagai spesies yang menerima anion atau melepaskan kation, sementara basa didefinisikan sebagai spesies yang menerima kation atau melepaskan anion. Teori Usanovich dapat menjelaskan berbagai reaksi, termasuk reaksi yang melibatkan transfer proton, transfer elektron, dan reaksi redoks.
Perbandingan dengan Teori Asam-Basa Lainnya
Teori Brønsted-Lowry merupakan salah satu teori yang menjelaskan konsep asam-basa. Teori ini punya kelebihan dan kekurangan, dan perlu dibandingkan dengan teori lainnya untuk memahami konsep asam-basa secara menyeluruh.
Perbandingan dengan Teori Arrhenius
Teori Arrhenius, yang dikemukakan oleh Svante Arrhenius, adalah teori asam-basa pertama yang muncul. Teori ini mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, sedangkan basa menghasilkan ion hidroksida (OH-) dalam larutan.
- Teori Brønsted-Lowry lebih luas dibandingkan dengan teori Arrhenius karena mencakup reaksi asam-basa yang tidak melibatkan air.
- Teori Brønsted-Lowry juga menjelaskan reaksi asam-basa dalam pelarut non-air, seperti amonia cair dan asam asetat glasial.
- Teori Arrhenius hanya berlaku untuk reaksi asam-basa dalam larutan air.
Perbandingan dengan Teori Lewis
Teori Lewis, yang dikemukakan oleh Gilbert N. Lewis, mendefinisikan asam sebagai zat yang dapat menerima pasangan elektron, sedangkan basa sebagai zat yang dapat menyumbangkan pasangan elektron.
- Teori Lewis lebih luas lagi dibandingkan dengan teori Brønsted-Lowry karena mencakup reaksi yang tidak melibatkan transfer proton.
- Teori Lewis dapat menjelaskan reaksi asam-basa yang melibatkan senyawa yang tidak memiliki atom hidrogen, seperti reaksi antara boron trifluorida (BF3) dan amonia (NH3).
- Teori Brønsted-Lowry hanya berlaku untuk reaksi yang melibatkan transfer proton.
Tabel Perbandingan
Berikut adalah tabel yang membandingkan ketiga teori asam-basa:
| Teori | Definisi Asam | Definisi Basa | Contoh |
|---|---|---|---|
| Arrhenius | Zat yang menghasilkan ion hidrogen (H+) dalam larutan | Zat yang menghasilkan ion hidroksida (OH-) dalam larutan | HCl, HNO3, NaOH, KOH |
| Brønsted-Lowry | Zat yang dapat mendonorkan proton (H+) | Zat yang dapat menerima proton (H+) | HCl, HNO3, NH3, H2O |
| Lewis | Zat yang dapat menerima pasangan elektron | Zat yang dapat menyumbangkan pasangan elektron | BF3, AlCl3, NH3, H2O |
Contoh Reaksi Asam-Basa Berdasarkan Teori Brønsted-Lowry
Teori Brønsted-Lowry memberikan definisi yang lebih luas tentang asam dan basa dibandingkan dengan teori Arrhenius. Teori ini berfokus pada transfer proton (H+) dalam reaksi kimia. Berdasarkan teori ini, asam didefinisikan sebagai zat yang dapat mendonorkan proton, sedangkan basa didefinisikan sebagai zat yang dapat menerima proton.
Reaksi Asam-Basa Sederhana
Salah satu contoh reaksi asam-basa sederhana yang sesuai dengan teori Brønsted-Lowry adalah reaksi antara asam klorida (HCl) dan air (H2O).
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)
Dalam reaksi ini, asam klorida (HCl) bertindak sebagai asam karena mendonorkan proton ke air (H2O). Air (H2O) bertindak sebagai basa karena menerima proton dari asam klorida.
Identifikasi Asam, Basa, Asam Konjugat, dan Basa Konjugat
Dalam reaksi asam-basa, terdapat pasangan asam-basa konjugat. Asam konjugat adalah basa yang terbentuk setelah asam kehilangan proton, sedangkan basa konjugat adalah asam yang terbentuk setelah basa menerima proton.
- Asam: HCl
- Basa: H2O
- Asam Konjugat: H3O+
- Basa Konjugat: Cl-
Contoh Reaksi Asam-Basa Lainnya
Berikut adalah beberapa contoh reaksi asam-basa lainnya yang sesuai dengan teori Brønsted-Lowry:
- Reaksi antara asam asetat (CH3COOH) dan air (H2O):
CH3COOH(aq) + H2O(l) ⇌ H3O+(aq) + CH3COO-(aq)
- Reaksi antara amonia (NH3) dan air (H2O):
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH-(aq)
- Reaksi antara asam sulfat (H2SO4) dan air (H2O):
H2SO4(aq) + H2O(l) ⇌ H3O+(aq) + HSO4-(aq)
Aplikasi Teori Brønsted-Lowry dalam Bidang Biologi
Oke, udah paham kan tentang teori Brønsted-Lowry? Nah, ternyata teori ini gak cuma penting buat kimia aja, lho. Teori ini punya peran penting banget dalam memahami proses biologis yang terjadi di dalam tubuh kita. Kayak gimana sih? Yuk, kita bahas!
Peran Teori Brønsted-Lowry dalam Proses Biologis
Teori Brønsted-Lowry membantu kita ngerti tentang transfer proton (H+) yang terjadi dalam reaksi biologis. Transfer proton ini penting banget buat berbagai proses, seperti:
- Aktivitas enzim: Enzim, yang berperan sebagai katalis dalam reaksi biologis, seringkali menggunakan transfer proton untuk mengubah substrat menjadi produk. Misalnya, enzim protease memecah protein dengan menggunakan transfer proton untuk memutuskan ikatan peptida.
- Regulasi pH: pH tubuh kita harus dijaga dalam rentang tertentu agar semua proses biologis berjalan dengan baik. Teori Brønsted-Lowry membantu kita ngerti bagaimana buffer bekerja dalam menjaga keseimbangan pH tubuh.
- Transpor ion: Transfer proton juga penting dalam proses transpor ion melintasi membran sel. Misalnya, pompa proton yang ada di membran sel membantu dalam mengatur pH di dalam sel dan membantu dalam proses metabolisme.
Contoh Aplikasi Teori Brønsted-Lowry dalam Sistem Biologis
Teori Brønsted-Lowry punya banyak aplikasi di sistem biologis, nih. Contohnya:
- Enzim: Enzim karbonat anhidrase, yang berperan dalam respirasi seluler, menggunakan transfer proton untuk mengubah karbon dioksida menjadi bikarbonat. Proses ini membantu dalam pengangkutan karbon dioksida dari jaringan ke paru-paru.
- Buffer: Sistem buffer bikarbonat dalam darah merupakan contoh aplikasi teori Brønsted-Lowry dalam menjaga keseimbangan pH tubuh. Sistem ini terdiri dari asam karbonat (H2CO3) dan bikarbonat (HCO3-) yang bekerja sama dalam menetralkan asam dan basa yang masuk ke dalam darah.
Mekanisme Reaksi Biologis
Teori Brønsted-Lowry membantu kita ngerti mekanisme reaksi biologis dengan fokus pada transfer proton. Misalnya, dalam proses glikolisis, enzim yang terlibat menggunakan transfer proton untuk memecah glukosa menjadi piruvat. Transfer proton ini juga berperan dalam pembentukan ATP, sumber energi utama dalam sel.
Akhir Kata: Pengertian Basa Menurut Bronsted-lowry Adalah
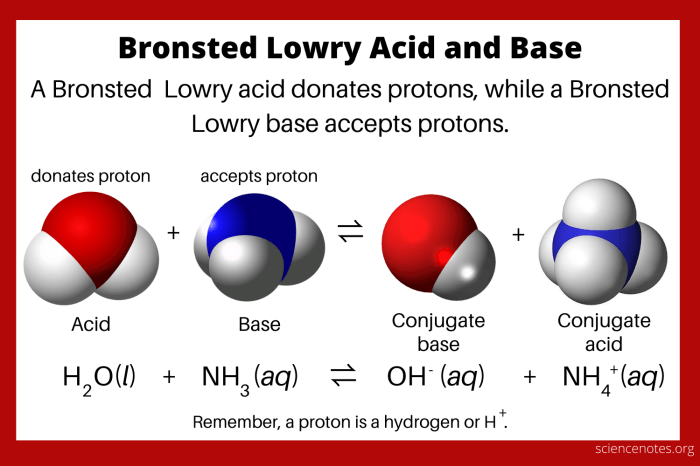
Teori Brønsted-Lowry membuka cakrawala baru dalam memahami sifat asam dan basa. Dengan fokus pada transfer proton, teori ini memberikan pemahaman yang lebih komprehensif tentang reaksi kimia. Teori ini juga membantu kita memahami proses biologis, seperti kerja enzim dan buffer dalam tubuh. Jadi, meskipun mungkin terdengar rumit, teori Brønsted-Lowry ternyata punya peran penting dalam dunia kimia dan kehidupan kita!
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru