Pengertian atom menurut thomson – Bayangkan sebuah roti kismis! Nah, itulah gambaran model atom menurut J.J. Thomson, seorang ilmuwan yang gemilang. Model ini muncul pada awal abad ke-20, saat dunia ilmu pengetahuan masih sibuk memecahkan misteri terkecil dari materi: atom. Sebelumnya, atom dianggap sebagai bola pejal yang tak terbagi. Namun, Thomson punya ide yang lebih ‘gurih’ – atom adalah bola bermuatan positif yang dihiasi ‘kismis’ elektron bermuatan negatif.
Penasaran bagaimana Thomson sampai pada model atomnya? Yuk, kita telusuri perjalanan pemikirannya yang mengubah pandangan kita tentang atom!
Latar Belakang Model Atom Thomson
Model atom Thomson muncul sebagai upaya untuk menjelaskan struktur atom yang lebih detail daripada model atom Dalton yang sebelumnya. Model atom Dalton menggambarkan atom sebagai bola pejal yang tidak terbagi. Namun, serangkaian penemuan ilmiah pada akhir abad ke-19 menunjukkan bahwa atom memiliki struktur internal yang lebih kompleks.
Penemuan Elektron
Penemuan elektron oleh J.J. Thomson pada tahun 1897 menjadi titik balik dalam pemahaman kita tentang atom. Thomson melakukan percobaan dengan tabung sinar katoda dan menemukan bahwa sinar katoda terdiri dari partikel bermuatan negatif yang jauh lebih kecil daripada atom. Partikel ini kemudian dikenal sebagai elektron.
Model Atom Dalton
Model atom Dalton, yang diusulkan pada tahun 1803, menggambarkan atom sebagai bola pejal yang tidak terbagi. Model ini berhasil menjelaskan beberapa sifat kimia, seperti hukum kekekalan massa dan hukum perbandingan tetap. Namun, model ini tidak dapat menjelaskan sifat listrik atom dan keberadaan elektron.
Masalah Model Atom Dalton
Model atom Dalton menghadapi beberapa masalah yang mendorong Thomson untuk mengembangkan modelnya sendiri. Beberapa masalah tersebut antara lain:
- Model Dalton tidak dapat menjelaskan keberadaan elektron, yang telah ditemukan oleh Thomson.
- Model Dalton tidak dapat menjelaskan sifat listrik atom.
- Model Dalton tidak dapat menjelaskan fenomena emisi cahaya dari atom, seperti spektrum garis.
Model Atom Thomson
Siapa sih yang gak kenal atom? Partikel terkecil yang membentuk segala sesuatu di alam semesta ini udah jadi objek penelitian para ilmuwan selama berabad-abad. Nah, salah satu model atom yang cukup populer adalah model atom Thomson. Dibuat oleh J.J. Thomson, model ini punya konsep unik yang berbeda dari model atom sebelumnya, yaitu model atom Dalton.
Model atom Thomson menggambarkan atom sebagai bola bermuatan positif yang padat dan berisi partikel bermuatan negatif yang tersebar di dalamnya. Bayangkan seperti roti kismis, dengan roti sebagai bola bermuatan positif dan kismis sebagai elektron yang tersebar di dalamnya. Konsep ini dikenal sebagai “model roti kismis”.
Model atom Thomson menggambarkan atom sebagai bola bermuatan positif yang padat dan berisi partikel bermuatan negatif yang tersebar di dalamnya.
Perbandingan Model Atom Thomson dengan Model Atom Dalton
Model atom Thomson berbeda dari model atom Dalton yang mendahuluinya. Model Dalton menggambarkan atom sebagai bola pejal yang tidak dapat dibagi lagi. Nah, Thomson memberikan gambaran yang lebih kompleks dengan memperkenalkan keberadaan elektron yang tersebar di dalam atom. Berikut perbandingannya:
- Model Dalton menggambarkan atom sebagai bola pejal yang tidak dapat dibagi lagi, sedangkan model Thomson menggambarkan atom sebagai bola bermuatan positif yang berisi elektron yang tersebar di dalamnya.
- Model Dalton tidak menjelaskan keberadaan elektron, sedangkan model Thomson memperkenalkan keberadaan elektron sebagai partikel bermuatan negatif yang tersebar di dalam atom.
- Model Dalton tidak menjelaskan bagaimana atom dapat bermuatan listrik, sedangkan model Thomson menjelaskan bahwa atom dapat bermuatan listrik karena keberadaan elektron yang dapat berpindah.
Asumsi dan Prinsip Model Atom Thomson: Pengertian Atom Menurut Thomson
Model atom Thomson, yang juga dikenal sebagai model “plum pudding”, merupakan langkah penting dalam pemahaman kita tentang struktur atom. Model ini mengusulkan bahwa atom bukan merupakan partikel yang tak terbagi, melainkan memiliki struktur internal. Thomson mengemukakan ide-ide inovatif yang membentuk dasar pemikiran atom modern. Untuk memahami model atom Thomson secara lebih mendalam, kita perlu menyelami asumsi dan prinsip-prinsip yang mendasarinya.
Asumsi Utama Model Atom Thomson
Asumsi utama yang mendasari model atom Thomson adalah bahwa atom terdiri dari muatan positif yang tersebar merata di seluruh atom, dan muatan negatif (elektron) tersebar di dalam muatan positif seperti kismis dalam puding. Asumsi ini didasarkan pada eksperimen tabung sinar katoda yang dilakukan Thomson sendiri. Dalam eksperimen ini, Thomson mengamati bahwa sinar katoda, yang merupakan aliran elektron, dapat dibelokkan oleh medan magnet. Dari hasil eksperimen ini, Thomson menyimpulkan bahwa elektron merupakan partikel bermuatan negatif.
Prinsip-Prinsip Dasar Model Atom Thomson
Model atom Thomson didasarkan pada beberapa prinsip dasar yang penting:
- Atom bersifat netral secara listrik. Ini berarti bahwa jumlah muatan positif dalam atom sama dengan jumlah muatan negatif.
- Atom terdiri dari muatan positif yang tersebar merata di seluruh atom, dan elektron-elektron yang tersebar di dalam muatan positif seperti kismis dalam puding.
- Elektron dapat bergerak bebas di dalam muatan positif. Hal ini menjelaskan mengapa elektron dapat dibelokkan oleh medan magnet dalam tabung sinar katoda.
Perbandingan Asumsi Model Atom Thomson dan Model Atom Dalton
Untuk memahami perbedaan antara model atom Thomson dan model atom Dalton, berikut tabel perbandingan:
| Aspek | Model Atom Dalton | Model Atom Thomson |
|---|---|---|
| Struktur Atom | Atom merupakan partikel yang tak terbagi dan padat. | Atom terdiri dari muatan positif yang tersebar merata di seluruh atom, dan elektron-elektron yang tersebar di dalam muatan positif seperti kismis dalam puding. |
| Muatan Atom | Atom tidak memiliki muatan. | Atom bersifat netral secara listrik. |
| Pembagian Muatan | Tidak ada pembagian muatan dalam atom. | Atom memiliki muatan positif dan negatif yang tersebar merata. |
| Pergerakan Elektron | Tidak ada pergerakan elektron dalam atom. | Elektron dapat bergerak bebas di dalam muatan positif. |
Bukti dan Percobaan Pendukung Model Atom Thomson
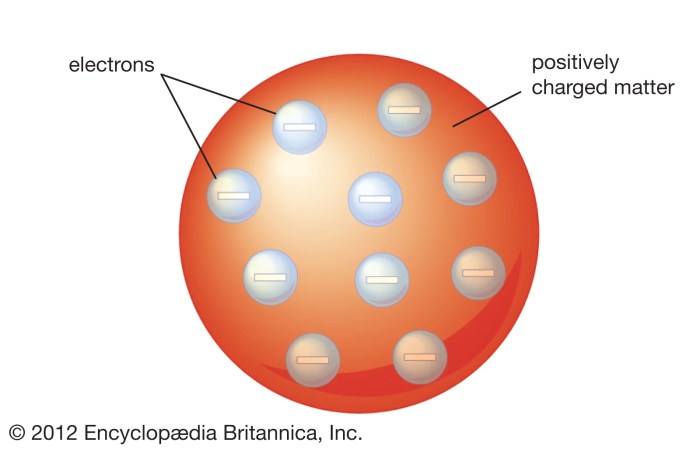
Model atom Thomson, yang sering disebut model “roti kismis”, menggambarkan atom sebagai bola bermuatan positif yang padat dengan elektron bermuatan negatif tersebar di dalamnya, seperti kismis di dalam roti. Model ini lahir dari hasil percobaan Thomson sendiri, yang akhirnya menjadi bukti kuat untuk mendukung teori atomnya.
Percobaan Sinar Katoda
Percobaan yang paling terkenal untuk mendukung model atom Thomson adalah percobaan sinar katoda. Percobaan ini dilakukan dengan menggunakan tabung kaca vakum yang dilengkapi dengan dua elektroda, yaitu katoda dan anoda. Ketika tegangan tinggi diberikan pada elektroda, arus listrik mengalir melalui tabung dan menghasilkan sinar yang keluar dari katoda, yang kemudian dikenal sebagai sinar katoda.
- Thomson menemukan bahwa sinar katoda dapat dibelokkan oleh medan magnet dan medan listrik. Ini menunjukkan bahwa sinar katoda terdiri dari partikel bermuatan negatif, yang kemudian disebut elektron.
- Hasil ini menguatkan gagasan bahwa atom bukanlah partikel yang tak terbagi, melainkan terdiri dari partikel yang lebih kecil. Thomson menyimpulkan bahwa elektron adalah partikel subatomik yang merupakan bagian dari atom.
Percobaan sinar katoda adalah bukti kuat bahwa atom bukanlah partikel yang tak terbagi, melainkan terdiri dari partikel yang lebih kecil.
Kelebihan dan Kekurangan Model Atom Thomson
Model atom Thomson, yang juga dikenal sebagai model atom roti kismis, mengusulkan bahwa atom merupakan bola bermuatan positif yang di dalamnya tersebar elektron bermuatan negatif. Model ini muncul sebagai upaya untuk menjelaskan sifat listrik atom dan bagaimana atom dapat menghasilkan arus listrik. Namun, seperti model atom lainnya, model atom Thomson juga memiliki kelebihan dan kekurangan.
Mengenal atom seperti menelisik inti dari segala sesuatu. Thomson, sang ilmuwan jenius, menggambarkan atom seperti roti kismis, dengan elektron-elektron tersebar di dalam bola bermuatan positif. Konsep ini mungkin terdengar sederhana, tapi punya kaitan erat dengan konsep pemberdayaan. Sama seperti atom yang memiliki inti kuat, sebuah komunitas juga butuh kekuatan dari dalam.
Pemberdayaan komunitas, seperti yang dijelaskan dalam pengertian pemberdayaan komunitas menurut para ahli , adalah tentang memicu potensi positif dari setiap individu dalam komunitas, sehingga mereka bisa berperan aktif dalam membangun masa depan bersama. Layaknya elektron yang berputar di sekitar inti atom, setiap anggota komunitas bisa menjadi ‘elektron’ yang berkontribusi untuk kemajuan bersama, membentuk kekuatan kolektif yang kuat.
Kelebihan Model Atom Thomson
Model atom Thomson memiliki beberapa kelebihan dibandingkan dengan model atom sebelumnya, yaitu model atom Dalton yang menggambarkan atom sebagai bola pejal yang tak terbagi. Kelebihan model atom Thomson adalah:
- Menjelaskan keberadaan elektron dalam atom. Model atom Thomson merupakan model atom pertama yang berhasil menjelaskan keberadaan elektron dalam atom. Hal ini didasarkan pada eksperimen tabung sinar katoda yang menunjukkan bahwa atom dapat melepaskan partikel bermuatan negatif, yang kemudian disebut sebagai elektron.
- Menjelaskan sifat listrik atom. Model atom Thomson menjelaskan bagaimana atom dapat menghasilkan arus listrik. Model ini menyatakan bahwa elektron dapat bergerak bebas di dalam bola bermuatan positif, sehingga atom dapat menghantarkan arus listrik.
Kekurangan Model Atom Thomson
Model atom Thomson memiliki beberapa kekurangan yang kemudian diatasi oleh model atom selanjutnya, yaitu model atom Rutherford. Kekurangan model atom Thomson adalah:
- Tidak dapat menjelaskan spektrum atom. Model atom Thomson tidak dapat menjelaskan mengapa atom memancarkan cahaya dengan spektrum tertentu. Spektrum atom menunjukkan bahwa atom hanya memancarkan cahaya dengan panjang gelombang tertentu, bukan cahaya dengan semua panjang gelombang.
- Tidak dapat menjelaskan hamburan sinar alfa. Eksperimen hamburan sinar alfa oleh Rutherford menunjukkan bahwa atom memiliki inti atom yang bermuatan positif. Model atom Thomson tidak dapat menjelaskan hasil eksperimen ini karena model ini menyatakan bahwa muatan positif tersebar merata di seluruh atom.
Tabel Kelebihan dan Kekurangan Model Atom Thomson
| Kelebihan | Kekurangan |
|---|---|
| Menjelaskan keberadaan elektron dalam atom. | Tidak dapat menjelaskan spektrum atom. |
| Menjelaskan sifat listrik atom. | Tidak dapat menjelaskan hamburan sinar alfa. |
Penerapan Model Atom Thomson
Model atom Thomson, dengan bola bermuatan positif yang dihiasi elektron, mungkin terlihat sederhana, tapi jangan salah, model ini punya pengaruh besar di dunia ilmu pengetahuan. Model ini menjadi batu loncatan untuk pemahaman kita tentang atom, dan dampaknya terasa sampai sekarang.
Penerapan Model Atom Thomson dalam Berbagai Bidang Ilmu Pengetahuan
Model atom Thomson memberikan dasar untuk memahami sifat-sifat atom, seperti muatan listrik dan struktur atom. Model ini juga membuka jalan untuk penelitian lebih lanjut tentang atom, yang akhirnya membawa kita ke model atom modern yang lebih kompleks.
- Kimia: Model atom Thomson membantu kita memahami bagaimana atom bergabung membentuk molekul. Model ini juga membantu menjelaskan mengapa unsur-unsur memiliki sifat kimia yang berbeda. Misalnya, kita bisa memahami mengapa natrium (Na) sangat reaktif, sementara helium (He) sangat inert.
- Fisika: Model atom Thomson membantu kita memahami sifat-sifat listrik dan magnetik atom. Model ini juga membantu kita memahami bagaimana atom berinteraksi dengan radiasi elektromagnetik.
- Biologi: Model atom Thomson membantu kita memahami bagaimana atom membentuk molekul organik yang penting bagi kehidupan. Model ini juga membantu kita memahami bagaimana atom berinteraksi dalam reaksi biokimia.
Contoh Penerapan Model Atom Thomson dalam Kehidupan Sehari-hari
Model atom Thomson punya peran penting dalam banyak teknologi yang kita gunakan sehari-hari. Berikut beberapa contohnya:
- Lampu Pijar: Model atom Thomson membantu kita memahami bagaimana elektron dalam atom logam berpindah, menghasilkan arus listrik yang kemudian memanaskan filamen lampu hingga berpijar.
- Baterai: Model atom Thomson membantu kita memahami bagaimana reaksi kimia dalam baterai menghasilkan arus listrik. Model ini juga membantu kita memahami bagaimana atom dalam elektroda baterai berinteraksi dengan ion dalam larutan elektrolit.
- Televisi: Model atom Thomson membantu kita memahami bagaimana elektron dalam tabung sinar katoda di televisi menghasilkan gambar.
Implikasi Model Atom Thomson terhadap Perkembangan Ilmu Pengetahuan dan Teknologi
Model atom Thomson, meskipun sederhana, memiliki dampak besar terhadap perkembangan ilmu pengetahuan dan teknologi. Berikut beberapa implikasinya:
- Perkembangan Model Atom: Model atom Thomson membuka jalan bagi pengembangan model atom yang lebih kompleks dan akurat, seperti model atom Rutherford dan model atom Bohr.
- Pengembangan Teknologi: Model atom Thomson membantu dalam pengembangan teknologi baru, seperti lampu pijar, baterai, dan televisi.
- Pengembangan Bidang Ilmu Pengetahuan: Model atom Thomson membantu dalam pengembangan berbagai bidang ilmu pengetahuan, seperti kimia, fisika, dan biologi.
Perkembangan Model Atom Setelah Thomson
Model atom Thomson memang revolusioner dengan konsep bola bermuatan positif yang dihiasi elektron, tapi ternyata masih ada yang kurang pas. Seperti teka-teki yang belum terpecahkan, para ilmuwan terus berburu jawaban untuk memahami struktur atom yang lebih akurat. Dari sinilah muncul model atom Rutherford, Bohr, dan akhirnya model atom modern, yang membawa kita pada pemahaman yang lebih detail tentang dunia atom.
Model Atom Rutherford
Model atom Rutherford muncul sebagai jawaban atas kekurangan model atom Thomson. Rutherford, yang terkenal dengan eksperimennya dengan lempeng emas, menemukan bahwa atom tidaklah seperti bola pejal bermuatan positif. Sebaliknya, atom memiliki inti atom yang kecil, padat, dan bermuatan positif, yang disebut nukleus. Elektron-elektron mengitari nukleus ini seperti planet mengelilingi matahari.
- Eksperimen Rutherford membuktikan bahwa sebagian besar atom adalah ruang kosong, dan hanya sebagian kecil yang terisi oleh inti atom yang padat.
- Model atom Rutherford berhasil menjelaskan mengapa sebagian besar partikel alfa menembus lempeng emas, sementara sebagian kecil lainnya dibelokkan atau bahkan dipantulkan kembali.
- Namun, model atom Rutherford masih memiliki kekurangan, yaitu tidak dapat menjelaskan mengapa elektron tidak jatuh ke inti atom karena gaya tarik elektrostatis antara elektron dan inti atom.
Model Atom Bohr
Model atom Bohr muncul untuk mengatasi kekurangan model atom Rutherford. Bohr mengajukan teori bahwa elektron-elektron dalam atom hanya dapat berada pada orbit tertentu dengan tingkat energi tertentu. Elektron-elektron tidak dapat berada di antara orbit-orbit tersebut, dan mereka hanya dapat berpindah orbit dengan menyerap atau memancarkan energi dalam bentuk foton.
- Model atom Bohr berhasil menjelaskan spektrum atom hidrogen, yang tidak dapat dijelaskan oleh model atom Rutherford.
- Teori Bohr juga menjelaskan mengapa atom-atom hanya memancarkan cahaya pada panjang gelombang tertentu ketika dipanaskan.
- Namun, model atom Bohr hanya berlaku untuk atom hidrogen, dan tidak dapat menjelaskan spektrum atom yang lebih kompleks.
Model Atom Modern
Model atom modern merupakan gabungan dari konsep-konsep yang ada dalam model atom Rutherford dan Bohr. Model atom modern menyatakan bahwa atom terdiri dari inti atom yang berisi proton dan neutron, serta elektron yang mengitari inti atom dalam orbital-orbital tertentu. Orbital-orbital ini merupakan daerah ruang di sekitar inti atom yang memiliki peluang terbesar untuk menemukan elektron.
- Model atom modern menggunakan teori mekanika kuantum untuk menjelaskan perilaku elektron dalam atom.
- Model ini menjelaskan bahwa elektron tidak bergerak dalam orbit yang pasti seperti yang digambarkan dalam model atom Bohr, tetapi berada dalam orbital-orbital yang memiliki bentuk dan energi tertentu.
- Model atom modern merupakan model yang paling akurat dan lengkap yang kita miliki saat ini untuk menjelaskan struktur atom.
Signifikansi Model Atom Thomson
Model atom Thomson, yang diusulkan oleh J.J. Thomson pada tahun 1904, adalah model atom yang revolusioner. Model ini mengajukan konsep atom sebagai bola bermuatan positif dengan elektron tersebar di dalamnya seperti kismis dalam roti. Model ini, meskipun sederhana, membawa dampak besar dalam sejarah perkembangan ilmu kimia.
Peran Model Atom Thomson dalam Sejarah Ilmu Kimia
Model atom Thomson merupakan tonggak penting dalam sejarah perkembangan ilmu kimia. Sebelumnya, atom dianggap sebagai partikel yang tidak terbagi. Namun, Thomson berhasil menunjukkan bahwa atom memiliki struktur internal, yaitu terdiri dari partikel bermuatan positif dan negatif. Penemuan ini membuka jalan bagi pemahaman yang lebih mendalam tentang sifat kimia dan fisika materi.
Kontribusi Model Atom Thomson terhadap Pemahaman Struktur Atom
Model atom Thomson memberikan kontribusi signifikan terhadap pemahaman kita tentang struktur atom. Model ini menjelaskan beberapa fenomena yang sebelumnya tidak dapat dijelaskan, seperti keberadaan elektron dan sifat listrik materi. Model ini juga membantu memahami bagaimana atom dapat membentuk ikatan kimia dan membentuk molekul.
Landasan bagi Model Atom Selanjutnya
Meskipun model atom Thomson memiliki kekurangan, seperti tidak dapat menjelaskan spektrum atom, model ini menjadi landasan bagi model atom selanjutnya. Model atom Rutherford, yang mengusulkan bahwa atom memiliki inti atom yang bermuatan positif dan elektron yang mengitari inti, merupakan pengembangan dari model atom Thomson. Model atom Bohr, yang menjelaskan spektrum atom dengan menggunakan konsep kuantum, juga terinspirasi dari model atom Thomson.
Ringkasan Terakhir
Model atom Thomson, meskipun sederhana, telah membuka jalan bagi pemahaman kita tentang atom yang lebih kompleks. Model ini menunjukkan bahwa atom bukanlah bola pejal, melainkan memiliki struktur internal yang terdiri dari partikel-partikel bermuatan. Meskipun model Thomson kemudian digantikan oleh model yang lebih canggih, kontribusinya terhadap perkembangan ilmu kimia dan fisika tak terbantahkan. Model atom Thomson, seperti roti kismis yang sederhana, telah memicu revolusi dalam dunia ilmu pengetahuan dan membuka jalan bagi penemuan-penemuan baru yang menakjubkan.
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru