Pengertian atom menurut john dalton – Pernah bertanya-tanya, apa sih sebenarnya yang membuat benda-benda di sekitar kita terbentuk? Dari air yang kita minum hingga udara yang kita hirup, semuanya tersusun dari partikel terkecil yang tak terlihat mata: atom. Dan John Dalton, seorang ilmuwan jenius, adalah orang pertama yang memberikan gambaran jelas tentang atom ini. Dia bukan hanya membayangkannya, tapi juga merumuskan teori yang menjadi tonggak sejarah dalam ilmu kimia.
Teori atom Dalton muncul pada awal abad ke-19, saat ilmu pengetahuan tentang atom masih dalam tahap awal. Sebelum Dalton, para ilmuwan hanya memiliki ide samar tentang atom. Tapi Dalton, dengan ketekunannya, berhasil menyusun lima postulat yang menjadi dasar pemahaman kita tentang atom hingga saat ini. Penasaran dengan teori atom Dalton yang revolusioner ini? Yuk, kita telusuri bersama!
Latar Belakang Teori Atom Dalton
Sebelum Dalton muncul dengan teorinya, pemahaman tentang atom masih samar. Para ilmuwan hanya berasumsi bahwa materi tersusun dari partikel kecil yang tak terbagi, namun tidak ada model yang pasti untuk menggambarkannya.
Teori Atom Sebelum Dalton
Beberapa teori atom yang muncul sebelum Dalton antara lain:
- Teori Atom Democritus (400 SM): Democritus berpendapat bahwa materi tersusun dari partikel-partikel kecil yang tak terbagi yang disebut atom. Namun, teorinya ini hanya berdasarkan pemikiran filosofis, tanpa didukung bukti eksperimen.
- Teori Atom Aristoteles (350 SM): Aristoteles menolak teori atom Democritus dan percaya bahwa materi tersusun dari empat unsur dasar: tanah, air, udara, dan api. Teori ini lebih diterima oleh masyarakat pada saat itu karena didukung oleh filosofi Aristoteles yang berpengaruh.
Perbandingan Teori Atom Sebelum Dalton dengan Teori Atom Dalton
Berikut adalah perbandingan teori atom sebelum Dalton dengan teori atom Dalton:
| Teori | Poin Utama |
|---|---|
| Teori Atom Democritus | – Materi tersusun dari partikel-partikel kecil yang tak terbagi yang disebut atom. – Atom bersifat kekal dan tidak dapat dihancurkan. – Atom memiliki bentuk dan ukuran yang berbeda-beda. |
| Teori Atom Aristoteles | – Materi tersusun dari empat unsur dasar: tanah, air, udara, dan api. – Atom dapat dibagi menjadi bagian yang lebih kecil. – Atom dapat berubah menjadi unsur lain. |
| Teori Atom Dalton | – Materi tersusun dari partikel-partikel kecil yang tak terbagi yang disebut atom. – Atom dari unsur yang sama memiliki sifat dan massa yang sama. – Atom dari unsur yang berbeda memiliki sifat dan massa yang berbeda. – Atom tidak dapat diciptakan atau dihancurkan, hanya dapat disusun ulang. – Atom bergabung dalam rasio sederhana untuk membentuk senyawa. |
Ilustrasi Model Atom Dalton
Model atom Dalton menggambarkan atom sebagai bola pejal yang padat dan tak terbagi. Misalnya, jika kita membayangkan air, menurut Dalton, air tersusun dari atom-atom hidrogen dan oksigen yang bergabung dalam rasio tertentu. Setiap atom hidrogen dan oksigen merupakan bola pejal yang tak terbagi, dan keduanya bergabung membentuk molekul air.
Postulat Teori Atom Dalton
Kamu pasti pernah mendengar tentang atom, kan? Nah, sebelum kita bahas lebih lanjut tentang atom, yuk kita kenalan dulu dengan Bapak John Dalton, seorang ilmuwan yang punya peran penting dalam memahami atom. Pada tahun 1803, John Dalton merumuskan teori atomnya yang mengubah cara pandang kita tentang materi. Teori ini menjadi tonggak sejarah dalam perkembangan ilmu kimia.
Lima Postulat Teori Atom Dalton
Teori atom Dalton didasarkan pada lima postulat, yang merupakan pernyataan-pernyataan dasar yang menjadi landasan teori ini. Berikut adalah kelima postulat tersebut, dijabarkan dengan bahasa yang mudah dipahami.
| Postulat | Penjelasan |
|---|---|
| 1. Semua materi tersusun atas partikel-partikel kecil yang disebut atom. | Bayangkan materi seperti lego, yang terdiri dari banyak balok kecil. Nah, atom itu seperti balok kecil penyusun materi. Atom adalah partikel terkecil yang tidak dapat dibagi lagi. |
| 2. Atom-atom suatu unsur memiliki sifat dan massa yang sama. | Atom-atom emas, misalnya, memiliki sifat dan massa yang sama. Begitu juga dengan atom-atom karbon, hidrogen, atau unsur lainnya. |
| 3. Atom-atom unsur yang berbeda memiliki sifat dan massa yang berbeda. | Atom emas berbeda dengan atom karbon, baik dari segi sifat maupun massanya. Atom emas lebih berat dan lebih padat daripada atom karbon. |
| 4. Atom-atom tidak dapat diciptakan atau dimusnahkan, tetapi dapat bergabung atau terpisah dalam reaksi kimia. | Dalam reaksi kimia, atom-atom tidak hilang atau muncul tiba-tiba. Mereka hanya bergabung atau terpisah untuk membentuk zat baru. |
| 5. Senyawa terbentuk dari perpaduan atom-atom dari unsur-unsur yang berbeda dalam perbandingan tertentu. | Air, misalnya, terbentuk dari perpaduan atom hidrogen dan atom oksigen dengan perbandingan 2:1. Jadi, satu molekul air terdiri dari dua atom hidrogen dan satu atom oksigen. |
Mengapa Teori Atom Dalton Penting?
Teori atom Dalton menjadi tonggak sejarah dalam perkembangan ilmu kimia karena beberapa alasan:
- Teori atom Dalton memberikan penjelasan ilmiah tentang sifat materi. Sebelum Dalton, orang hanya beranggapan bahwa materi terdiri dari unsur-unsur yang tidak dapat dibagi lagi. Dalton menunjukkan bahwa materi tersusun atas atom, yang merupakan partikel terkecil yang tidak dapat dibagi lagi.
- Teori atom Dalton menjadi dasar bagi perkembangan kimia modern. Berkat teori ini, para ilmuwan dapat memahami bagaimana atom-atom bergabung untuk membentuk molekul dan senyawa, serta bagaimana reaksi kimia terjadi.
- Teori atom Dalton membuka jalan bagi penelitian lebih lanjut tentang atom. Setelah Dalton, para ilmuwan mulai mempelajari struktur atom, sifat-sifat atom, dan bagaimana atom berinteraksi satu sama lain.
Bukti-Bukti Pendukung Teori Atom Dalton
Teori atom Dalton memang revolusioner, tapi nggak langsung diterima begitu aja. Perlu bukti-bukti kuat yang ngebuat para ilmuwan lain percaya sama ide briliannya. Nah, bukti-bukti ini datang dari hukum-hukum dasar kimia yang udah ditemukan sebelumnya, lho. Yuk, kita bahas satu per satu!
Hukum Kekekalan Massa dan Hukum Perbandingan Tetap
Hukum kekekalan massa, yang menyatakan bahwa massa total zat sebelum dan sesudah reaksi kimia tetap sama, ngedukung teori atom Dalton. Kenapa? Karena Dalton percaya kalau atom nggak bisa diciptain atau dihancurin, tapi cuma bisa disusun ulang. Jadi, saat reaksi kimia terjadi, atom-atom hanya bertukar posisi, bukan hilang atau muncul begitu aja.
Nah, hukum perbandingan tetap juga punya peran penting. Hukum ini bilang, kalau suatu senyawa selalu mengandung unsur-unsur yang sama dengan perbandingan massa yang tetap. Misalnya, air selalu terdiri dari hidrogen dan oksigen dengan perbandingan massa 1:8. Ini sejalan sama teori atom Dalton yang menyatakan bahwa atom-atom suatu unsur punya sifat dan massa yang sama.
Hukum Perbandingan Berganda
Hukum perbandingan berganda ngejelasin bahwa kalau dua unsur bisa membentuk lebih dari satu senyawa, maka massa salah satu unsur yang bergabung dengan massa tetap unsur lainnya akan membentuk perbandingan bilangan bulat sederhana.
- Misalnya, karbon dan oksigen bisa membentuk dua senyawa, yaitu karbon monoksida (CO) dan karbon dioksida (CO2). Dalam CO, massa oksigen yang bergabung dengan 12 gram karbon adalah 16 gram, sedangkan dalam CO2, massa oksigen yang bergabung dengan 12 gram karbon adalah 32 gram. Perbandingan massa oksigen dalam kedua senyawa ini adalah 16:32, atau 1:2, yang merupakan perbandingan bilangan bulat sederhana.
Teori atom Dalton berhasil ngejelasin hukum perbandingan berganda ini. Menurut Dalton, atom-atom bergabung dalam perbandingan bilangan bulat sederhana untuk membentuk senyawa. Jadi, dalam CO, satu atom karbon bergabung dengan satu atom oksigen, sedangkan dalam CO2, satu atom karbon bergabung dengan dua atom oksigen.
Contoh Ilustrasi Eksperimen
Bayangin kamu punya dua wadah, satu berisi air dan satu lagi berisi gula. Kamu kemudian mencampurkan keduanya. Apa yang terjadi? Gula akan larut dalam air, dan kamu nggak akan bisa lagi melihat gula secara terpisah. Tapi, kamu tahu kalau gula masih ada di dalam air, karena airnya jadi lebih manis.
Eksperimen ini ngasih gambaran tentang bagaimana atom-atom bekerja. Meskipun gula dan air udah tercampur, atom-atomnya tetap ada dan nggak hilang. Ini ngedukung teori atom Dalton yang menyatakan bahwa atom nggak bisa diciptain atau dihancurin, hanya bisa disusun ulang.
Kelemahan Teori Atom Dalton
Teori atom Dalton, meskipun revolusioner pada masanya, memiliki beberapa kelemahan yang terungkap seiring berkembangnya ilmu pengetahuan. Beberapa teori baru muncul yang mengungkap sisi lain dari atom yang tidak dapat dijelaskan oleh teori Dalton. Apa saja kelemahan teori atom Dalton? Yuk, kita bahas!
John Dalton, bapak atom modern, mencetuskan teori bahwa atom adalah partikel terkecil yang tidak dapat dibagi lagi. Mirip dengan teori atom, konsep kewarganegaraan juga memiliki berbagai definisi dari para ahli. Pengertian kewarganegaraan menurut para ahli beragam, mulai dari hak dan kewajiban warga negara hingga ikatan emosional dengan suatu negara.
Sama seperti atom yang membentuk segala sesuatu, begitu pula warga negara yang membentuk sebuah bangsa.
Teori atom Dalton menyatakan bahwa semua atom suatu unsur memiliki sifat dan massa yang sama. Namun, perkembangan ilmu pengetahuan menunjukkan bahwa hal ini tidak sepenuhnya benar. Ada atom-atom dari unsur yang sama yang memiliki massa berbeda. Atom-atom ini disebut isotop. Contohnya, karbon memiliki dua isotop utama, yaitu karbon-12 dan karbon-14. Karbon-12 memiliki 6 proton dan 6 neutron, sedangkan karbon-14 memiliki 6 proton dan 8 neutron. Hal ini menunjukkan bahwa teori atom Dalton tidak dapat menjelaskan keberadaan isotop.
Teori Atom Dalton Tidak Dapat Menjelaskan Fenomena Radioaktivitas
Teori atom Dalton tidak dapat menjelaskan fenomena radioaktivitas, yaitu proses peluruhan inti atom yang memancarkan radiasi. Radioaktivitas menunjukkan bahwa atom tidak selalu stabil dan dapat berubah menjadi atom lain. Hal ini bertentangan dengan teori atom Dalton yang menyatakan bahwa atom merupakan partikel yang tidak dapat dibagi lagi.
Fenomena radioaktivitas menunjukkan bahwa atom memiliki struktur internal yang lebih kompleks daripada yang dibayangkan Dalton. Atom terdiri dari inti atom yang mengandung proton dan neutron, serta elektron yang mengelilingi inti. Inti atom dapat mengalami peluruhan, menghasilkan partikel radioaktif seperti sinar alfa, beta, dan gamma.
Teori atom Dalton tidak dapat menjelaskan fenomena ini karena ia tidak mempertimbangkan struktur internal atom dan tidak menyinggung kemungkinan perubahan atom menjadi atom lain.
Kontribusi Teori Atom Dalton
Teori atom Dalton, yang lahir pada awal abad ke-19, adalah tonggak penting dalam sejarah kimia. Teori ini membuka jalan bagi pemahaman mendalam tentang materi dan bagaimana atom membentuk berbagai zat. Walaupun beberapa aspek teori Dalton telah direvisi seiring kemajuan ilmu pengetahuan, fondasinya tetap menjadi dasar bagi perkembangan teori atom modern.
Bagaimana Teori Atom Dalton Berkontribusi pada Perkembangan Teori Atom Selanjutnya?
Teori atom Dalton tidak hanya menjelaskan sifat materi, tetapi juga membuka jalan bagi penelitian dan pengembangan teori atom selanjutnya. Teori Dalton, yang berbasis pada konsep atom sebagai partikel terkecil yang tidak dapat dibagi lagi, menjadi dasar bagi para ilmuwan untuk mempelajari lebih lanjut tentang struktur atom dan bagaimana atom berinteraksi satu sama lain.
Kontribusi Teori Atom Dalton
Teori atom Dalton memberikan sumbangsih besar bagi perkembangan ilmu kimia. Kontribusinya dapat dirangkum dalam tabel berikut:
| Aspek Teori Atom | Kontribusi terhadap Ilmu Kimia |
|---|---|
| Atom adalah partikel terkecil yang tidak dapat dibagi lagi | Menjelaskan sifat materi dan memberikan dasar bagi pemahaman tentang struktur atom |
| Atom dari unsur yang sama memiliki sifat dan massa yang sama | Memungkinkan penetapan standar massa atom dan pengembangan tabel periodik unsur |
| Atom dari unsur yang berbeda memiliki sifat dan massa yang berbeda | Menjelaskan perbedaan sifat antara berbagai zat dan memungkinkan prediksi reaksi kimia |
| Senyawa terbentuk dari perpaduan atom-atom dari unsur yang berbeda dalam perbandingan tertentu | Menjelaskan komposisi senyawa dan memungkinkan perhitungan stoikiometri |
| Reaksi kimia melibatkan penataan ulang atom, bukan penciptaan atau penghancuran atom | Menjelaskan hukum kekekalan massa dan hukum perbandingan tetap |
Aplikasi Teori Atom Dalton dalam Kehidupan Sehari-hari
Teori atom Dalton memiliki aplikasi yang luas dalam kehidupan sehari-hari. Misalnya, dalam industri makanan, teori atom digunakan untuk menentukan komposisi dan kandungan nutrisi dalam makanan. Dalam industri farmasi, teori atom digunakan untuk mengembangkan obat-obatan baru dan memahami bagaimana obat-obatan berinteraksi dengan tubuh.
Contoh lainnya adalah dalam bidang pertanian. Teori atom digunakan untuk memahami proses fotosintesis dan bagaimana tanaman menyerap nutrisi dari tanah. Dalam industri tekstil, teori atom digunakan untuk mengembangkan serat sintetis yang kuat dan tahan lama.
Perkembangan Teori Atom Setelah Dalton: Pengertian Atom Menurut John Dalton
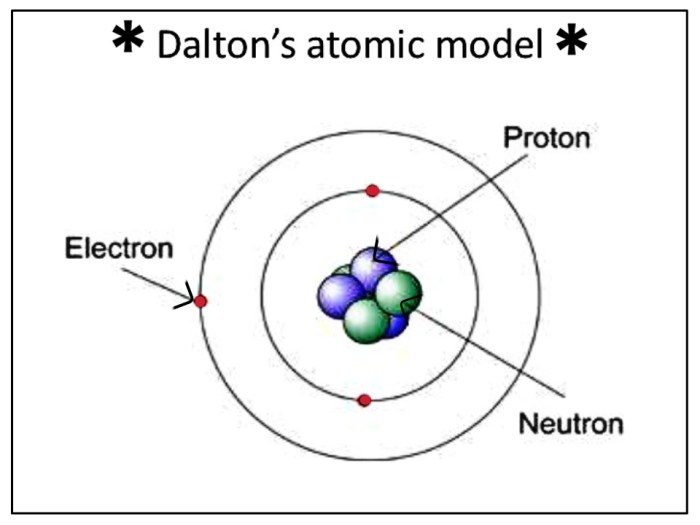
Teori atom Dalton yang revolusioner menjadi batu loncatan dalam memahami materi. Namun, seiring dengan perkembangan ilmu pengetahuan, teori atom Dalton mengalami penyempurnaan dan modifikasi. Beberapa ilmuwan dengan eksperimen dan pemikiran mereka memberikan kontribusi penting dalam mengungkap misteri atom yang lebih dalam.
Teori Atom Thomson
Tahun 1897, J.J. Thomson, seorang fisikawan Inggris, melakukan percobaan dengan tabung sinar katoda. Dalam percobaan tersebut, ia menemukan partikel bermuatan negatif yang disebut elektron. Thomson kemudian mencetuskan model atom yang dikenal sebagai “model atom roti kismis”. Model ini menggambarkan atom sebagai bola bermuatan positif yang padat, dengan elektron tersebar di dalamnya seperti kismis dalam roti.
Teori Atom Rutherford
Ernest Rutherford, murid Thomson, melakukan percobaan penghamburan sinar alfa pada lempeng tipis emas pada tahun 1911. Hasil percobaan ini menunjukkan bahwa atom bukanlah bola padat, tetapi memiliki inti atom yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif. Model atom Rutherford menggambarkan atom sebagai sistem tata surya mini, dengan inti atom sebagai matahari dan elektron mengelilinginya seperti planet.
Teori Atom Bohr
Niels Bohr, seorang fisikawan Denmark, menyempurnakan model atom Rutherford dengan menggabungkan teori kuantum Planck. Bohr menyatakan bahwa elektron hanya dapat berada pada tingkat energi tertentu dan bergerak dalam orbit melingkar di sekitar inti atom. Ketika elektron berpindah tingkat energi, atom akan menyerap atau memancarkan energi dalam bentuk cahaya.
Perbandingan Model Atom
| Model Atom | Struktur Atom | Kelebihan | Kekurangan |
|---|---|---|---|
| Dalton | Bola pejal yang tak terbagi | Menjelaskan hukum kekekalan massa dan hukum perbandingan tetap | Tidak dapat menjelaskan sifat listrik dan magnetik atom |
| Thomson | Bola bermuatan positif dengan elektron tersebar di dalamnya | Menjelaskan keberadaan elektron dalam atom | Tidak dapat menjelaskan struktur atom secara detail |
| Rutherford | Inti atom bermuatan positif yang dikelilingi elektron | Menjelaskan struktur atom dengan inti atom dan elektron | Tidak dapat menjelaskan spektrum atom |
| Bohr | Elektron bergerak dalam orbit melingkar di sekitar inti atom | Menjelaskan spektrum atom dan sifat kimia atom | Tidak dapat menjelaskan spektrum atom yang kompleks |
Ilustrasi Model Atom
Model atom Thomson dapat diilustrasikan sebagai bola bermuatan positif yang padat, dengan elektron tersebar di dalamnya seperti kismis dalam roti. Model atom Rutherford dapat diilustrasikan sebagai sistem tata surya mini, dengan inti atom sebagai matahari dan elektron mengelilinginya seperti planet. Model atom Bohr dapat diilustrasikan sebagai elektron yang bergerak dalam orbit melingkar di sekitar inti atom, dengan tingkat energi yang berbeda.
Penerapan Teori Atom Dalton dalam Bidang Kimia
Teori atom Dalton yang sederhana tapi brilian, membuka jalan bagi pemahaman kita tentang materi. Bukan hanya sekadar teori abstrak, tapi teori ini juga menjadi landasan bagi perkembangan kimia modern. Dari penentuan rumus kimia senyawa, massa molekul relatif, hingga persamaan reaksi kimia, teori atom Dalton memberikan kerangka kerja yang solid untuk memahami dan memprediksi sifat-sifat materi.
Penentuan Rumus Kimia Senyawa
Teori atom Dalton menjelaskan bahwa senyawa terbentuk dari perpaduan atom-atom unsur yang berbeda dalam perbandingan tertentu. Dengan kata lain, rumus kimia senyawa merepresentasikan perbandingan atom-atom penyusunnya. Misalnya, air (H2O) terdiri dari 2 atom hidrogen dan 1 atom oksigen.
- Teori atom Dalton membantu kita memahami bahwa rumus kimia senyawa bukan sekadar simbol, tapi mencerminkan komposisi atomiknya.
- Rumus kimia yang tepat sangat penting dalam memahami reaksi kimia dan memprediksi produk yang dihasilkan.
Penentuan Massa Molekul Relatif
Teori atom Dalton juga memberikan dasar untuk menentukan massa molekul relatif (Mr). Massa molekul relatif merupakan perbandingan massa suatu molekul dengan 1/12 massa atom karbon-12. Teori atom Dalton menyatakan bahwa setiap atom memiliki massa tertentu, dan massa molekul merupakan penjumlahan massa atom penyusunnya.
- Dengan mengetahui massa atom relatif (Ar) setiap unsur, kita dapat menghitung Mr suatu senyawa dengan mudah.
- Contohnya, Mr air (H2O) adalah 18, karena Ar H = 1 dan Ar O = 16, sehingga Mr H2O = (2 x 1) + 16 = 18.
Penentuan Persamaan Reaksi Kimia
Teori atom Dalton membantu kita memahami bahwa reaksi kimia melibatkan penataan ulang atom-atom, bukan penciptaan atau penghancuran atom. Persamaan reaksi kimia menunjukkan perubahan yang terjadi pada atom-atom selama reaksi.
- Persamaan reaksi kimia harus seimbang, artinya jumlah atom setiap unsur di ruas kiri (reaktan) harus sama dengan jumlah atom di ruas kanan (produk).
- Contohnya, reaksi pembakaran metana (CH4) dengan oksigen (O2) menghasilkan karbon dioksida (CO2) dan air (H2O):
CH4 + 2O2 → CO2 + 2H2O
- Persamaan reaksi ini menunjukkan bahwa 1 molekul metana bereaksi dengan 2 molekul oksigen menghasilkan 1 molekul karbon dioksida dan 2 molekul air.
- Teori atom Dalton memberikan dasar untuk memahami persamaan reaksi kimia dan memprediksi hasil reaksi kimia.
Perkembangan Teori Atom di Masa Depan
Teori atom yang kita kenal saat ini, dengan model atom Bohr dan pengembangannya, merupakan hasil dari perjalanan panjang para ilmuwan dalam memahami struktur terkecil materi. Namun, perjalanan ini tidak berhenti di sini. Masih banyak misteri yang tersembunyi di dalam atom, dan teknologi modern membuka jalan bagi kita untuk mengungkapnya. Dengan alat-alat canggih dan teknik penelitian yang semakin inovatif, kita dapat menelisik lebih dalam tentang struktur atom dan menguji batas-batas pengetahuan kita tentang dunia mikroskopis.
Pengembangan Teknologi untuk Mengungkap Rahasia Atom
Teknologi modern telah memainkan peran penting dalam perkembangan teori atom. Dengan menggunakan alat-alat seperti akselerator partikel dan mikroskop elektron, para ilmuwan dapat mempelajari struktur atom dengan lebih detail. Akselerator partikel memungkinkan para ilmuwan untuk mempercepat partikel ke kecepatan tinggi dan menabrakkan mereka dengan atom, yang kemudian dapat digunakan untuk mempelajari struktur internal atom. Sementara itu, mikroskop elektron memungkinkan kita untuk melihat struktur atom dengan resolusi yang sangat tinggi. Teknologi-teknologi ini membuka pintu bagi penelitian yang lebih mendalam dan pengujian teori yang lebih akurat.
Misteri yang Masih Belum Terpecahkan
Meskipun kemajuan teknologi telah memberikan kita pemahaman yang lebih baik tentang atom, masih banyak pertanyaan yang belum terjawab. Beberapa contoh pertanyaan penelitian yang masih belum terpecahkan tentang struktur atom adalah:
- Bagaimana cara kerja gaya nuklir kuat yang mengikat proton dan neutron di dalam inti atom?
- Apakah ada partikel dasar lain di dalam atom selain yang sudah kita ketahui?
- Bagaimana cara memprediksi perilaku atom dalam kondisi ekstrem, seperti di dalam bintang neutron?
Prospek di Masa Depan
Dengan berkembangnya teknologi, kita dapat berharap untuk melihat lebih banyak penemuan dan pemahaman yang lebih dalam tentang struktur atom di masa depan. Pengembangan teknologi baru, seperti komputer kuantum, dapat memungkinkan kita untuk mensimulasikan perilaku atom dengan lebih akurat dan mengungkap rahasia yang belum terpecahkan. Penelitian tentang atom akan terus menjadi pusat perhatian para ilmuwan, karena atom merupakan dasar dari semua materi di alam semesta.
Pemungkas
Teori atom Dalton, meskipun memiliki kelemahan, telah membuka jalan bagi perkembangan ilmu kimia modern. Berkat teorinya, kita dapat memahami berbagai fenomena kimia, seperti reaksi kimia dan pembentukan senyawa. Teori ini juga menjadi landasan bagi para ilmuwan selanjutnya untuk mengembangkan model atom yang lebih canggih. Dari Dalton, kita belajar bahwa ilmu pengetahuan terus berkembang, dan pemahaman kita tentang alam semesta selalu terbuka untuk diuji dan disempurnakan.
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru