Pengertian asam menurut bronsted lowry – Pernah dengar istilah asam dan basa? Yap, mereka adalah duo dinamis dalam dunia kimia yang punya peran penting dalam berbagai reaksi. Tapi, kamu tahu nggak kalau pengertian asam dan basa itu bisa dibedah lebih dalam lagi? Salah satunya adalah teori Brønsted-Lowry, yang punya perspektif unik tentang siapa sebenarnya asam dan basa itu.
Teori Brønsted-Lowry mengusung konsep sederhana namun revolusioner: asam adalah zat yang suka banget ngasih proton (H+), sementara basa adalah zat yang suka banget nerima proton. Sederhana kan? Tapi, jangan salah, teori ini membuka pintu ke pemahaman lebih mendalam tentang asam basa, termasuk bagaimana mereka bereaksi dan membentuk pasangan konjugasi. Penasaran? Yuk, kita telusuri lebih lanjut!
Pengertian Asam Menurut Brønsted-Lowry
Asam dan basa adalah konsep fundamental dalam kimia yang menggambarkan sifat suatu zat berdasarkan kemampuannya untuk menyumbangkan atau menerima proton (ion hidrogen, H+). Konsep ini sangat penting dalam memahami berbagai reaksi kimia, termasuk reaksi asam-basa, reaksi redoks, dan reaksi pembentukan garam.
Seiring perkembangan ilmu kimia, berbagai teori asam basa telah dikemukakan untuk menjelaskan sifat asam dan basa secara lebih komprehensif. Beberapa teori asam basa yang terkenal, antara lain:
Teori Arrhenius
Teori Arrhenius, yang dikemukakan oleh Svante Arrhenius pada tahun 1884, mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan.
- Contoh asam Arrhenius adalah asam klorida (HCl) yang dalam air terionisasi menjadi H+ dan Cl-.
- Contoh basa Arrhenius adalah natrium hidroksida (NaOH) yang dalam air terionisasi menjadi Na+ dan OH-.
Teori Brønsted-Lowry
Teori Brønsted-Lowry, yang dikemukakan oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923, mendefinisikan asam sebagai zat yang dapat menyumbangkan proton (H+), sedangkan basa adalah zat yang dapat menerima proton.
Konsep asam menurut Bronsted-Lowry mungkin terdengar rumit, tapi bayangin gini: kalo kamu belajar tentang asam, kamu juga belajar tentang transfer proton. Nah, sama seperti pengertian teknologi informasi menurut para ahli yang selalu berkembang, teori Bronsted-Lowry tentang asam juga terus diperbarui dengan penemuan-penemuan baru.
Jadi, memahami konsep asam dan basa ini penting banget buat ngembangin pengetahuan kimia kita, sebagaimana memahami teknologi informasi penting buat ngembangin dunia kita.
Teori Brønsted-Lowry memiliki beberapa keunggulan dibandingkan teori Arrhenius, yaitu:
- Teori Brønsted-Lowry lebih umum dan dapat diterapkan pada berbagai macam reaksi kimia, termasuk reaksi yang tidak melibatkan air.
- Teori Brønsted-Lowry menjelaskan mengapa beberapa zat yang tidak mengandung ion hidroksida dapat bertindak sebagai basa, seperti amonia (NH3).
Teori Lewis
Teori Lewis, yang dikemukakan oleh Gilbert Newton Lewis pada tahun 1923, mendefinisikan asam sebagai zat yang dapat menerima pasangan elektron, sedangkan basa adalah zat yang dapat menyumbangkan pasangan elektron.
Teori Lewis lebih umum dibandingkan dengan teori Brønsted-Lowry karena dapat menjelaskan reaksi yang melibatkan zat yang tidak mengandung proton, seperti reaksi antara boron trifluorida (BF3) dan amonia (NH3).
Teori Brønsted-Lowry
Kamu mungkin sudah familiar dengan teori asam basa Arrhenius yang menjelaskan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, dan basa sebagai zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Nah, teori Brønsted-Lowry datang untuk memperluas definisi asam basa dengan pendekatan yang lebih luas dan universal.
Definisi Asam dan Basa Brønsted-Lowry
Teori Brønsted-Lowry mendefinisikan asam dan basa berdasarkan kemampuan mereka untuk menyumbangkan atau menerima proton (H+). Simak definisinya:
- Asam Brønsted-Lowry: Sebuah zat yang dapat menyumbangkan proton (H+).
- Basa Brønsted-Lowry: Sebuah zat yang dapat menerima proton (H+).
Contoh Reaksi Asam Basa Brønsted-Lowry
Yuk, kita lihat contoh reaksi asam basa berdasarkan teori Brønsted-Lowry. Perhatikan bagaimana proton berpindah dari asam ke basa:
HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
Dalam reaksi ini:
- HCl adalah asam Brønsted-Lowry karena menyumbangkan proton (H+) ke H2O.
- H2O adalah basa Brønsted-Lowry karena menerima proton (H+) dari HCl.
- H3O+ (ion hidronium) adalah asam konjugat dari H2O, terbentuk setelah menerima proton.
- Cl- (ion klorida) adalah basa konjugat dari HCl, terbentuk setelah menyumbangkan proton.
Jadi, dalam teori Brønsted-Lowry, asam dan basa selalu bekerja berpasangan. Setiap kali asam menyumbangkan proton, basa akan menerimanya, dan sebaliknya. Ini membentuk pasangan asam-basa konjugat.
Asam Brønsted-Lowry
Oke, kita sudah bahas tentang asam Arrhenius. Tapi, ternyata ada teori lain yang lebih luas tentang asam, lho! Yap, teori Brønsted-Lowry. Teori ini lebih umum karena nggak cuma berlaku buat senyawa yang mengandung hidrogen, tapi juga bisa buat senyawa lain yang bisa melepas proton.
Ciri-ciri Asam Brønsted-Lowry
Jadi, asam Brønsted-Lowry ini punya ciri khas. Mereka adalah senyawa yang bisa memberikan proton (H+) ke senyawa lain. Bayangin, kayak kamu ngasih barang ke temen, gitu. Nah, senyawa yang nerima proton ini disebut basa Brønsted-Lowry.
Contoh Asam Brønsted-Lowry
Banyak banget senyawa yang bisa jadi asam Brønsted-Lowry, lho! Misalnya, asam klorida (HCl). Ketika HCl dilarutkan dalam air, dia bakal ngasih proton ke air, membentuk ion hidronium (H3O+) dan ion klorida (Cl-).
HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
Nah, di reaksi ini, HCl bertindak sebagai asam Brønsted-Lowry karena dia ngasih proton ke air. Sementara air bertindak sebagai basa Brønsted-Lowry karena dia nerima proton.
Tabel Asam Brønsted-Lowry
Nih, tabel yang berisi beberapa asam Brønsted-Lowry, rumus kimianya, dan contoh reaksinya. Siap-siap, ya!
| Asam Brønsted-Lowry | Rumus Kimia | Contoh Reaksi |
|---|---|---|
| Asam Klorida | HCl | HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq) |
| Asam Sulfat | H2SO4 | H2SO4(aq) + H2O(l) → H3O+(aq) + HSO4-(aq) |
| Asam Nitrat | HNO3 | HNO3(aq) + H2O(l) → H3O+(aq) + NO3-(aq) |
| Asam Asetat | CH3COOH | CH3COOH(aq) + H2O(l) → H3O+(aq) + CH3COO-(aq) |
Basa Brønsted-Lowry: Pengertian Asam Menurut Bronsted Lowry
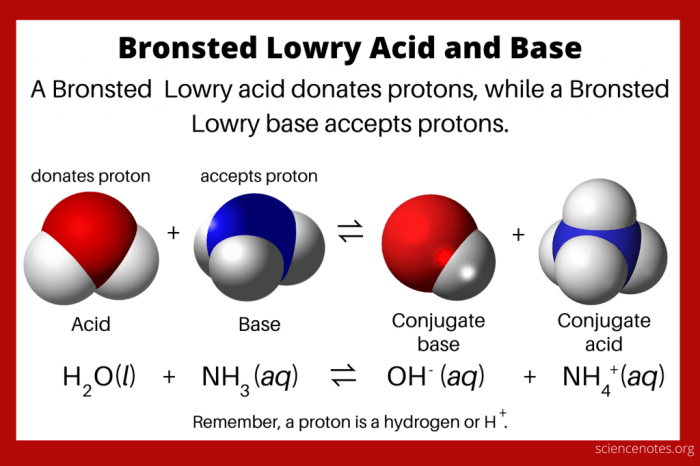
Nah, kalau kamu udah paham tentang asam Brønsted-Lowry, sekarang saatnya kita bahas pasangannya, yaitu basa Brønsted-Lowry. Kayak dua sisi mata uang, asam dan basa Brønsted-Lowry selalu berdampingan dalam reaksi kimia. Basa Brønsted-Lowry punya peran penting dalam menentukan sifat suatu zat dan bagaimana zat itu bereaksi dengan zat lainnya.
Ciri-ciri Basa Brønsted-Lowry
Jadi, apa sih ciri-ciri khas basa Brønsted-Lowry? Sederhananya, basa Brønsted-Lowry adalah zat yang bisa menerima proton (H+). Bayangin aja, proton itu kayak bola kecil yang bisa dilempar dari satu zat ke zat lain. Nah, basa Brønsted-Lowry adalah zat yang suka “menangkap” bola proton ini. Makin banyak proton yang bisa ditangkap, makin kuat basanya.
Contoh Senyawa Basa Brønsted-Lowry
Ada banyak senyawa yang bisa bertindak sebagai basa Brønsted-Lowry. Misalnya, air (H2O) adalah basa Brønsted-Lowry karena bisa menerima proton dari asam. Coba perhatikan reaksi berikut:
HCl + H2O → H3O+ + Cl-
Dalam reaksi ini, air menerima proton dari asam klorida (HCl) dan membentuk ion hidronium (H3O+). Ini menunjukkan bahwa air berperan sebagai basa Brønsted-Lowry. Contoh lainnya adalah amonia (NH3). Amonia juga bisa menerima proton dan membentuk ion amonium (NH4+).
Tabel Basa Brønsted-Lowry
Buat kamu yang suka belajar dengan tabel, ini dia beberapa contoh basa Brønsted-Lowry, rumus kimianya, dan contoh reaksinya:
| Basa Brønsted-Lowry | Rumus Kimia | Contoh Reaksi |
|---|---|---|
| Air | H2O | HCl + H2O → H3O+ + Cl- |
| Amonia | NH3 | NH3 + H+ → NH4+ |
| Ion hidroksida | OH- | OH- + H+ → H2O |
| Ion karbonat | CO32- | CO32- + 2H+ → H2CO3 |
Konjugasi Asam-Basa
Oke, jadi kita udah bahas teori Brønsted-Lowry tentang asam dan basa, kan? Nah, sekarang kita bakal ngebahas konsep pasangan konjugasi asam-basa. Ini penting banget buat ngerti gimana reaksi asam-basa terjadi, lho. Jadi, siap-siap ya, kita bakal bahas ini bareng-bareng!
Dalam teori Brønsted-Lowry, pasangan konjugasi asam-basa adalah dua spesies kimia yang berbeda hanya dengan satu proton (H+). Singkatnya, asam dan basa itu kayak pasangan yang saling melengkapi, gitu!
Asam adalah spesies yang bisa mendonorkan proton, sedangkan basa adalah spesies yang bisa menerima proton. Ketika asam mendonorkan proton, dia berubah menjadi basa konjugatnya. Begitu juga, ketika basa menerima proton, dia berubah menjadi asam konjugatnya.
Contoh Reaksi Asam-Basa dan Pasangan Konjugasi
Coba kita lihat contohnya ya. Misal, reaksi antara asam klorida (HCl) dengan air (H2O). Dalam reaksi ini, HCl adalah asam dan H2O adalah basa.
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl−(aq)
Dalam reaksi ini, HCl mendonorkan proton ke H2O. HCl berubah menjadi Cl−, yang merupakan basa konjugatnya. Sementara itu, H2O menerima proton dan berubah menjadi H3O+, yang merupakan asam konjugatnya.
Jadi, dalam reaksi ini, kita punya dua pasangan konjugasi:
- Pasangan konjugasi 1: HCl (asam) dan Cl− (basa konjugat)
- Pasangan konjugasi 2: H2O (basa) dan H3O+ (asam konjugat)
Diagram Sederhana Transfer Proton
Untuk lebih jelasnya, coba perhatikan diagram sederhana ini:
[Gambar sederhana yang menggambarkan transfer proton dalam reaksi asam-basa. Gambar ini menunjukkan asam (HA) mendonorkan proton (H+) ke basa (B), membentuk asam konjugat (BH+) dan basa konjugat (A−). Pasangan konjugasi ditunjukkan dengan garis putus-putus.]
Diagram ini menunjukkan asam (HA) mendonorkan proton (H+) ke basa (B), membentuk asam konjugat (BH+) dan basa konjugat (A−). Pasangan konjugasi ditunjukkan dengan garis putus-putus.
Kekuatan Asam dan Basa
Nah, sekarang kita masuk ke level selanjutnya dalam memahami asam dan basa, yaitu kekuatannya. Gak semua asam sama kuatnya, lho! Ada yang kuat banget, ada juga yang lemah. Begitu juga dengan basa. Kenapa sih kekuatan asam dan basa bisa beda-beda? Yuk, kita bahas!
Faktor-faktor yang Memengaruhi Kekuatan Asam dan Basa
Ada beberapa faktor yang memengaruhi kekuatan asam dan basa, nih. Faktor-faktor ini menentukan seberapa mudah suatu asam melepaskan proton (H+) atau seberapa mudah suatu basa menerima proton. Faktor-faktor tersebut meliputi:
- Ikatan kimia: Ikatan kimia dalam asam dan basa menentukan seberapa kuat proton (H+) terikat pada molekul. Semakin lemah ikatannya, semakin mudah proton terlepas dan semakin kuat asamnya. Sebaliknya, semakin kuat ikatannya, semakin lemah asamnya.
- Struktur molekul: Bentuk dan susunan atom dalam molekul juga berpengaruh. Misalnya, asam karboksilat (R-COOH) memiliki ikatan hidrogen yang kuat, sehingga asam ini cenderung lebih lemah dibandingkan dengan asam mineral seperti HCl.
- Efek induksi: Efek induksi adalah pengaruh elektron yang ditarik atau didorong oleh gugus lain dalam molekul. Efek induksi ini bisa membuat ikatan antara proton dan molekul asam lebih lemah, sehingga asamnya lebih kuat.
- Efek resonansi: Efek resonansi terjadi ketika elektron dalam molekul terdelokalisasi, sehingga ikatan kimia menjadi lebih stabil. Efek ini bisa membuat asam lebih lemah karena proton lebih kuat terikat pada molekul.
- Pelarut: Pelarut tempat asam atau basa dilarutkan juga memengaruhi kekuatannya. Misalnya, asam asetat (CH3COOH) lebih kuat dalam pelarut air daripada dalam pelarut eter.
Contoh Asam dan Basa Kuat dan Lemah
Gimana cara membedakan asam dan basa kuat dan lemah? Secara sederhana, asam kuat akan terionisasi sepenuhnya dalam larutan, artinya semua molekul asam akan melepaskan protonnya. Sementara, asam lemah hanya sebagian kecil molekulnya yang terionisasi. Begitu juga dengan basa.
- Asam kuat: Asam kuat biasanya terionisasi sepenuhnya dalam larutan. Contohnya adalah asam klorida (HCl), asam sulfat (H2SO4), dan asam nitrat (HNO3). Asam kuat ini sangat reaktif dan bisa menyebabkan luka bakar yang serius.
- Asam lemah: Asam lemah hanya terionisasi sebagian dalam larutan. Contohnya adalah asam asetat (CH3COOH), asam karbonat (H2CO3), dan asam benzoat (C6H5COOH). Asam lemah ini biasanya tidak sekuat asam kuat dan lebih aman digunakan.
- Basa kuat: Basa kuat akan terionisasi sepenuhnya dalam larutan, artinya semua molekul basa akan menerima proton. Contohnya adalah natrium hidroksida (NaOH), kalium hidroksida (KOH), dan kalsium hidroksida (Ca(OH)2). Basa kuat ini juga sangat reaktif dan berbahaya.
- Basa lemah: Basa lemah hanya terionisasi sebagian dalam larutan. Contohnya adalah amonia (NH3), natrium karbonat (Na2CO3), dan natrium bikarbonat (NaHCO3). Basa lemah ini biasanya tidak sekuat basa kuat dan lebih aman digunakan.
Tabel Kekuatan Asam dan Basa
| Asam/Basa | Rumus Kimia | Kekuatan |
|---|---|---|
| Asam klorida | HCl | Kuat |
| Asam sulfat | H2SO4 | Kuat |
| Asam nitrat | HNO3 | Kuat |
| Asam asetat | CH3COOH | Lemah |
| Asam karbonat | H2CO3 | Lemah |
| Asam benzoat | C6H5COOH | Lemah |
| Natrium hidroksida | NaOH | Kuat |
| Kalium hidroksida | KOH | Kuat |
| Kalsium hidroksida | Ca(OH)2 | Kuat |
| Amonia | NH3 | Lemah |
| Natrium karbonat | Na2CO3 | Lemah |
| Natrium bikarbonat | NaHCO3 | Lemah |
Aplikasi Teori Brønsted-Lowry
Oke, jadi kamu udah paham kan tentang konsep asam dan basa menurut Brønsted-Lowry? Nah, sekarang kita bahas aplikasi praktisnya, biar kamu nggak cuma ngerti teori doang tapi juga bisa ngelihat gimana teori ini bekerja di kehidupan sehari-hari.
Aplikasi dalam Kimia Organik
Teori Brønsted-Lowry punya peran penting dalam kimia organik, terutama dalam memahami reaksi-reaksi yang melibatkan asam dan basa. Misalnya, dalam reaksi esterifikasi, asam karboksilat bereaksi dengan alkohol untuk membentuk ester dan air. Asam karboksilat berperan sebagai donor proton (asam Brønsted-Lowry), sedangkan alkohol berperan sebagai akseptor proton (basa Brønsted-Lowry).
Aplikasi dalam Biokimia
Di dunia biokimia, teori Brønsted-Lowry juga berperan penting. Misalnya, dalam pencernaan makanan, enzim pepsin di lambung berperan sebagai katalis dalam pemecahan protein. Pepsin bekerja optimal dalam lingkungan asam, yang disebabkan oleh asam klorida (HCl) yang dihasilkan oleh lambung. HCl adalah asam Brønsted-Lowry yang melepaskan proton dan membantu pepsin bekerja secara efektif.
Aplikasi dalam Kimia Analitik
Dalam kimia analitik, teori Brønsted-Lowry digunakan dalam berbagai metode analisis, seperti titrasi asam-basa. Titrasi ini merupakan teknik yang digunakan untuk menentukan konsentrasi suatu larutan dengan menggunakan larutan standar yang sudah diketahui konsentrasinya.
- Contohnya, dalam titrasi asam-basa, larutan asam yang tidak diketahui konsentrasinya dititrasi dengan larutan basa standar (misalnya, NaOH). Reaksi yang terjadi adalah reaksi netralisasi asam-basa, di mana asam melepaskan proton dan basa menerima proton.
- Dengan mengetahui volume larutan basa standar yang dibutuhkan untuk mencapai titik ekivalen (titik di mana asam dan basa habis bereaksi), kita dapat menghitung konsentrasi asam yang tidak diketahui.
Contoh Aplikasi dalam Kehidupan Sehari-hari
- Pencernaan Makanan: Seperti yang sudah dibahas sebelumnya, asam klorida (HCl) di lambung berperan penting dalam pencernaan makanan. HCl membantu memecah makanan dan mengaktifkan enzim pencernaan, seperti pepsin.
- Pembentukan Hujan Asam: Hujan asam terjadi ketika gas-gas seperti sulfur dioksida (SO2) dan nitrogen oksida (NOx) bereaksi dengan air di atmosfer, membentuk asam sulfat (H2SO4) dan asam nitrat (HNO3). Asam-asam ini kemudian jatuh ke bumi bersama air hujan, menyebabkan kerusakan lingkungan.
- Penggunaan Asam dalam Industri: Asam memiliki berbagai aplikasi dalam industri, seperti pembuatan pupuk, deterjen, dan bahan kimia lainnya. Misalnya, asam sulfat (H2SO4) digunakan dalam produksi pupuk, baterai, dan berbagai bahan kimia lainnya. Asam klorida (HCl) digunakan dalam pembuatan plastik, pestisida, dan berbagai bahan kimia lainnya.
Contoh Kasus: Titrasi Asam-Basa
Misalnya, kita ingin menentukan konsentrasi larutan asam cuka (CH3COOH) yang tidak diketahui. Kita dapat menggunakan larutan basa standar, seperti NaOH, untuk menitrasi asam cuka.
Reaksi yang terjadi:
CH3COOH (aq) + NaOH (aq) → CH3COONa (aq) + H2O (l)
Dalam reaksi ini, asam cuka (CH3COOH) berperan sebagai donor proton (asam Brønsted-Lowry), sedangkan NaOH berperan sebagai akseptor proton (basa Brønsted-Lowry). Dengan mengetahui volume NaOH yang dibutuhkan untuk mencapai titik ekivalen, kita dapat menghitung konsentrasi asam cuka yang tidak diketahui.
Penutupan
Nah, sekarang kamu udah punya gambaran lebih jelas tentang asam dan basa menurut Brønsted-Lowry. Teori ini bukan hanya sekedar teori, tapi punya aplikasi nyata di berbagai bidang, mulai dari kimia organik sampai biokimia. Jadi, next time kamu ngobrolin asam basa, jangan lupa sebut teori Brønsted-Lowry ya!
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru