Pengertian asam basa menurut lewis – Pernah dengar tentang asam dan basa? Yap, mereka bukan cuma bahan kimia yang bikin kamu bersin di lab, tapi juga kunci untuk memahami berbagai reaksi kimia di dunia. Salah satu cara untuk memahami asam dan basa adalah dengan teori Lewis. Teori ini, yang diajukan oleh kimiawan Amerika Gilbert N. Lewis, punya cara pandang yang unik dan menarik, lho. Bukan cuma tentang proton atau ion hidroksida, tapi tentang pasangan elektron yang berdansa dalam reaksi kimia.
Teori Lewis membuka cakrawala baru dalam memahami reaksi kimia. Bukan cuma reaksi asam basa sederhana, tapi juga reaksi kompleks seperti pembentukan kompleks koordinasi dan katalis. Teori ini bahkan punya peran penting dalam pengembangan obat-obatan baru, lho! Jadi, siap untuk menyelami dunia asam basa menurut Lewis dan melihat bagaimana teori ini mengubah cara kita memandang reaksi kimia?
Pengertian Asam Basa Menurut Lewis
Kamu mungkin sudah familiar dengan teori asam basa Brønsted-Lowry, yang menjelaskan asam sebagai donor proton dan basa sebagai penerima proton. Nah, ternyata ada teori lain yang menjelaskan asam basa dengan cara yang lebih luas, yaitu teori asam basa Lewis. Teori ini lebih umum dan mencakup lebih banyak reaksi kimia. Penasaran, kan? Yuk, kita bahas lebih lanjut!
Definisi Asam Basa Menurut Lewis
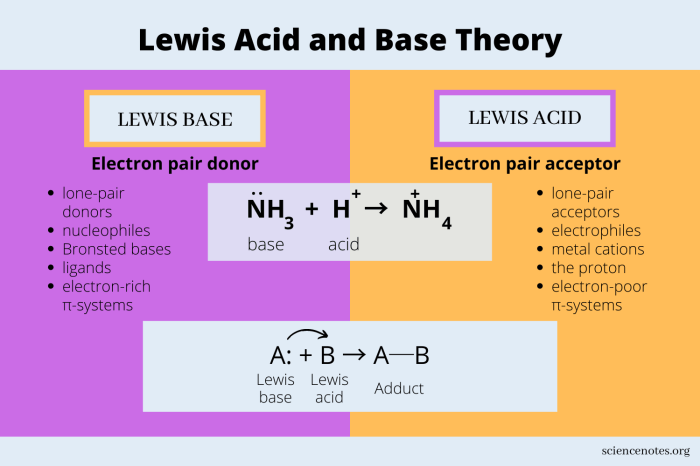
Teori asam basa Lewis berfokus pada perpindahan pasangan elektron. Menurut Lewis, asam adalah zat yang dapat menerima pasangan elektron, sedangkan basa adalah zat yang dapat mendonorkan pasangan elektron. Jadi, asam basa Lewis bukan lagi tentang proton, melainkan tentang perpindahan elektron.
Contoh Reaksi Kimia Asam Basa Menurut Lewis
Untuk memahami teori asam basa Lewis, yuk kita lihat contoh reaksinya. Misalnya, reaksi antara trimetilaluminium (Al(CH3)3) dan trietilamina (N(CH2CH3)3). Dalam reaksi ini, trimetilaluminium bertindak sebagai asam Lewis karena atom aluminiumnya memiliki orbital kosong yang dapat menerima pasangan elektron dari nitrogen pada trietilamina. Trietilamina, di sisi lain, bertindak sebagai basa Lewis karena atom nitrogennya memiliki pasangan elektron bebas yang dapat didonorkan.
Al(CH3)3 + N(CH2CH3)3 → Al(CH3)3N(CH2CH3)3
Reaksi ini membentuk kompleks koordinasi yang stabil, di mana atom aluminium terikat pada atom nitrogen melalui ikatan koordinasi.
Nah, sekarang kita bahas perbedaan antara teori asam basa Lewis dan Brønsted-Lowry. Perbedaan utamanya terletak pada definisi asam dan basa. Teori Brønsted-Lowry mendefinisikan asam sebagai donor proton dan basa sebagai penerima proton. Sementara itu, teori Lewis mendefinisikan asam sebagai penerima pasangan elektron dan basa sebagai donor pasangan elektron.
Teori Lewis lebih luas karena mencakup reaksi yang tidak melibatkan proton. Misalnya, reaksi antara BF3 dan NH3, di mana BF3 bertindak sebagai asam Lewis dan NH3 bertindak sebagai basa Lewis. Reaksi ini tidak melibatkan perpindahan proton, tetapi melibatkan perpindahan pasangan elektron dari atom nitrogen pada NH3 ke atom boron pada BF3.
- Teori Brønsted-Lowry fokus pada perpindahan proton, sedangkan teori Lewis fokus pada perpindahan pasangan elektron.
- Teori Lewis lebih luas dan mencakup lebih banyak reaksi kimia, termasuk reaksi yang tidak melibatkan proton.
- Teori Brønsted-Lowry adalah kasus khusus dari teori Lewis, di mana proton bertindak sebagai asam Lewis.
Ringkasan Akhir
Teori Lewis, dengan fokusnya pada pasangan elektron, memberikan pemahaman yang lebih luas tentang asam dan basa. Teori ini tidak hanya menjelaskan reaksi asam basa tradisional, tapi juga membuka pintu untuk memahami reaksi kompleks di berbagai bidang, mulai dari kimia organik hingga pengembangan obat-obatan. Jadi, saat kamu melihat reaksi kimia di sekitarmu, ingatlah bahwa ada pasangan elektron yang berdansa, mengikuti aturan teori Lewis, dan menciptakan keajaiban kimia yang menakjubkan!
Konsep asam basa menurut Lewis punya konsep unik: asam adalah penerima pasangan elektron, sementara basa adalah donor pasangan elektron. Mirip dengan konsep pengertian membaca menurut para ahli yang mendefinisikan membaca sebagai proses kompleks yang melibatkan decoding simbol dan menginterpretasikan makna, konsep Lewis ini juga melibatkan interaksi elektron.
Keduanya, baik membaca maupun konsep asam basa, menekankan pada proses interaksi yang kompleks untuk memahami makna dan menghasilkan hasil yang diinginkan.
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru