Jelaskan pengertian asam basa menurut bronsted lowry – Pernah bertanya-tanya kenapa jeruk nipis terasa asam dan sabun terasa licin? Nah, ternyata itu semua berhubungan dengan konsep asam basa! Salah satu teori yang menjelaskan fenomena ini adalah teori Brønsted-Lowry. Teori ini muncul di awal abad ke-20 dan memberikan pandangan baru tentang sifat asam dan basa, yang ternyata lebih kompleks daripada sekadar rasa atau tekstur.
Teori Brønsted-Lowry fokus pada pertukaran proton (H+) dalam reaksi kimia. Dengan kata lain, asam adalah zat yang bisa memberikan proton, sementara basa adalah zat yang bisa menerima proton. Konsep ini membuka pintu untuk memahami berbagai reaksi kimia, mulai dari proses pencernaan hingga pembuatan sabun.
Teori Asam Basa Brønsted-Lowry: Sebuah Pandangan Baru
Kamu pasti udah familiar dengan konsep asam dan basa, kan? Yap, dua zat yang berperan penting dalam berbagai reaksi kimia dan kehidupan sehari-hari. Nah, ternyata definisi asam dan basa nggak cuma satu, lho! Salah satunya adalah teori asam basa Brønsted-Lowry, yang memberikan pandangan baru dan lebih luas tentang konsep asam dan basa.
Teori ini diperkenalkan oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry secara independen pada tahun 1923. Mereka mendefinisikan asam dan basa berdasarkan kemampuannya untuk menerima atau melepaskan proton (H+). Jadi, bukan cuma soal rasa asam atau pahitnya, tapi juga tentang pertukaran ion hidrogen ini!
Sejarah Singkat Teori Brønsted-Lowry
Sebelum Brønsted dan Lowry, definisi asam basa yang paling umum adalah teori Arrhenius. Teori ini mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, dan basa sebagai zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Namun, teori ini terbatas pada reaksi dalam larutan air, dan tidak dapat menjelaskan semua reaksi asam basa.
Brønsted dan Lowry melihat bahwa konsep asam basa dapat diperluas ke reaksi dalam fase gas dan bahkan dalam pelarut non-air. Mereka berfokus pada pertukaran proton (H+) dalam reaksi kimia, yang lebih universal dan menjelaskan berbagai reaksi asam basa.
Contoh Reaksi Asam Basa Brønsted-Lowry
Untuk memahami teori ini lebih lanjut, yuk kita lihat contoh reaksi asam basa sederhana:
HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
Dalam reaksi ini, asam klorida (HCl) melepaskan proton (H+) dan menjadi ion klorida (Cl-), sedangkan air (H2O) menerima proton dan menjadi ion hidronium (H3O+). Jadi, HCl berperan sebagai asam Brønsted-Lowry, sedangkan air berperan sebagai basa Brønsted-Lowry.
Definisi Asam dan Basa Brønsted-Lowry
Oke, udah tahu kan tentang asam dan basa? Nah, selain definisi asam-basa yang udah kamu pelajari sebelumnya, ada teori lain yang lebih luas dan keren lho, yaitu teori asam-basa Brønsted-Lowry. Teori ini punya pandangan yang lebih umum dan bisa menjelaskan berbagai reaksi kimia yang melibatkan transfer proton.
Definisi Asam Brønsted-Lowry
Jadi, menurut Brønsted-Lowry, asam itu adalah zat yang bisa mendonorkan proton (H+). Ingat ya, proton itu sama dengan ion hidrogen (H+). Gampangnya, asam itu kayak ‘tukang bagi-bagi’ proton ke zat lain.
Asam Brønsted-Lowry adalah zat yang mendonorkan proton (H+).
Definisi Basa Brønsted-Lowry
Nah, kalau basa, kebalikannya. Basa Brønsted-Lowry adalah zat yang bisa menerima proton (H+). Jadi, basa itu kayak ‘tukang terima’ proton dari zat lain.
Basa Brønsted-Lowry adalah zat yang menerima proton (H+).
Contoh Asam dan Basa Brønsted-Lowry
Contohnya gini, kita punya asam klorida (HCl) yang merupakan asam Brønsted-Lowry karena bisa mendonorkan proton. Ketika dilarutkan dalam air, HCl akan melepaskan proton dan membentuk ion hidronium (H3O+) dan ion klorida (Cl-).
Teori Bronsted-Lowry menjelaskan asam dan basa berdasarkan kemampuan mereka untuk menerima atau melepaskan proton (H+). Asam adalah zat yang melepaskan proton, sedangkan basa menerima proton. Konsep ini mirip dengan manajemen, yang bisa diartikan sebagai proses untuk mencapai tujuan dengan menggunakan sumber daya yang ada.
Pengertian manajemen menurut para ahli tahun 2017 juga menekankan pada efisiensi dan efektivitas dalam mencapai tujuan. Sama seperti asam dan basa yang bereaksi untuk membentuk garam dan air, manajemen yang baik juga memerlukan sinergi antara berbagai elemen untuk menghasilkan hasil yang optimal.
- HCl (asam) + H2O (basa) → H3O+ (asam konjugat) + Cl- (basa konjugat)
Nah, di reaksi ini, air (H2O) bertindak sebagai basa karena menerima proton dari HCl. Asam konjugat dari HCl adalah ion hidronium (H3O+), sedangkan basa konjugat dari air adalah ion klorida (Cl-).
Contoh lain, kita punya amonia (NH3) yang merupakan basa Brønsted-Lowry karena bisa menerima proton. Ketika dilarutkan dalam air, amonia akan menerima proton dari air dan membentuk ion amonium (NH4+) dan ion hidroksida (OH-).
- NH3 (basa) + H2O (asam) → NH4+ (asam konjugat) + OH- (basa konjugat)
Di sini, air (H2O) bertindak sebagai asam karena mendonorkan proton ke amonia. Asam konjugat dari air adalah ion hidroksida (OH-), sedangkan basa konjugat dari amonia adalah ion amonium (NH4+).
Konsep Proton (H+) dalam Teori Brønsted-Lowry
Oke, jadi kita udah bahas definisi asam basa menurut Brønsted-Lowry. Sekarang, kita masuk ke inti dari teori ini: peran proton (H+). Kenapa proton jadi kunci utama? Karena transfer proton ini yang bikin suatu zat disebut asam atau basa.
Peran Proton (H+) dalam Reaksi Asam Basa Brønsted-Lowry
Bayangin aja, Brønsted-Lowry ngelihat asam basa dari sudut pandang transfer proton. Asam adalah zat yang bisa mendonorkan proton (H+), sedangkan basa adalah zat yang bisa menerima proton. Gampang kan?
Contoh Reaksi Transfer Proton
Nah, buat ngerti lebih jelas, kita lihat contoh reaksi asam basa yang menunjukkan transfer proton. Misal, reaksi antara asam klorida (HCl) dengan air (H2O):
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)
Di sini, HCl berperan sebagai asam karena dia mendonorkan proton (H+) ke air. Air, yang bertindak sebagai basa, menerima proton dan membentuk ion hidronium (H3O+). Jadi, intinya, reaksi asam basa Brønsted-Lowry adalah tentang pertukaran proton.
Pasangan Asam-Basa Konjugasi: Jelaskan Pengertian Asam Basa Menurut Bronsted Lowry
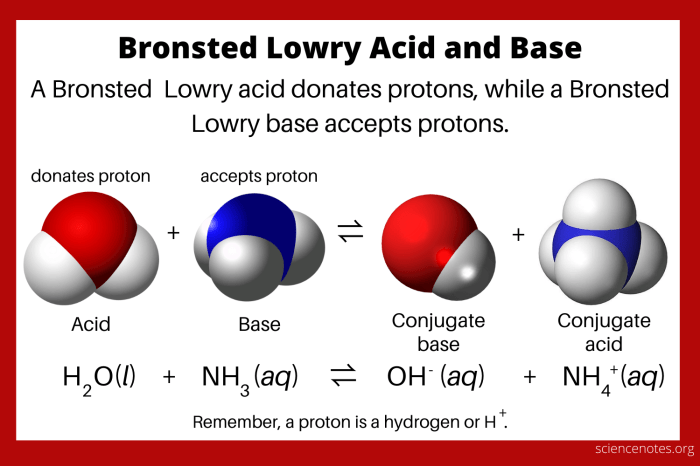
Nah, setelah memahami konsep asam dan basa menurut Brønsted-Lowry, kita akan masuk ke konsep yang sedikit lebih kompleks, yaitu pasangan asam-basa konjugasi. Konsep ini menjelaskan hubungan antara asam dan basa dalam reaksi asam-basa. Jadi, siap-siap untuk memahami bagaimana asam dan basa saling berhubungan dalam reaksi!
Konsep Pasangan Asam-Basa Konjugasi
Konsep pasangan asam-basa konjugasi menjelaskan hubungan antara asam dan basa dalam reaksi asam-basa. Dalam reaksi asam-basa Brønsted-Lowry, asam akan melepaskan proton (H+) dan menjadi basa konjugasi. Sementara itu, basa akan menerima proton (H+) dan menjadi asam konjugasi. Jadi, asam dan basa konjugasi ini merupakan pasangan yang saling berhubungan dalam reaksi.
Contoh Reaksi Asam-Basa Brønsted-Lowry dengan Identifikasi Pasangan Asam-Basa Konjugasi
Untuk memahami konsep ini lebih baik, yuk kita lihat contoh reaksi asam-basa Brønsted-Lowry dan identifikasi pasangan asam-basa konjugasi. Misalkan, kita punya reaksi antara asam klorida (HCl) dengan air (H2O):
HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
Dalam reaksi ini, asam klorida (HCl) melepaskan proton (H+) dan menjadi ion klorida (Cl-), yang merupakan basa konjugasinya. Sementara itu, air (H2O) menerima proton (H+) dan menjadi ion hidronium (H3O+), yang merupakan asam konjugasinya.
Tabel Pasangan Asam-Basa Konjugasi
Untuk lebih mudah memahami hubungan antara asam, basa, asam konjugasi, dan basa konjugasi, yuk kita lihat tabel berikut:
| Reaksi | Asam | Basa | Asam Konjugasi | Basa Konjugasi |
|---|---|---|---|---|
| HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq) | HCl | H2O | H3O+ | Cl- |
| NH3(aq) + H2O(l) → NH4+(aq) + OH-(aq) | H2O | NH3 | NH4+ | OH- |
Dari tabel di atas, kita bisa melihat bahwa dalam setiap reaksi asam-basa, selalu ada pasangan asam-basa konjugasi yang saling berhubungan. Asam akan melepaskan proton dan menjadi basa konjugasi, sementara basa akan menerima proton dan menjadi asam konjugasi. Paham, kan?
Kekuatan Asam dan Basa Brønsted-Lowry
Oke, kita udah bahas tentang teori Brønsted-Lowry, tapi gimana sih cara ngukur seberapa kuat asam atau basa itu? Teori ini juga punya jawabannya, geng! Kekuatan asam dan basa Brønsted-Lowry dipengaruhi oleh beberapa faktor, dan kita bakal bahas semuanya di sini.
Kekuatan asam dan basa Brønsted-Lowry ditentukan oleh seberapa mudah mereka melepaskan atau menerima proton (H+). Semakin mudah melepaskan proton, semakin kuat asamnya. Sebaliknya, semakin mudah menerima proton, semakin kuat basanya.
- Ikatan kimia: Ikatan antara atom hidrogen (H) dan atom lain dalam molekul asam menentukan seberapa mudah proton dilepaskan. Semakin lemah ikatannya, semakin mudah proton dilepaskan, dan semakin kuat asamnya. Misalnya, asam klorida (HCl) memiliki ikatan H-Cl yang lemah, sehingga mudah melepaskan proton dan merupakan asam kuat.
- Elektronegativitas: Elektronegativitas adalah kemampuan atom untuk menarik elektron. Semakin tinggi elektronegativitas atom yang terikat pada hidrogen, semakin kuat ikatannya, dan semakin sulit melepaskan proton. Contohnya, asam fluorida (HF) memiliki elektronegativitas fluor yang tinggi, sehingga ikatan H-F kuat dan HF adalah asam lemah.
- Efek induksi: Efek induksi terjadi ketika gugus fungsi tertentu dalam molekul menarik atau menolak elektron. Gugus penarik elektron membuat ikatan H-X lebih polar dan mempermudah pelepasan proton, sehingga asamnya lebih kuat. Sebaliknya, gugus pendorong elektron akan melemahkan asam.
- Efek resonansi: Resonansi terjadi ketika elektron dapat berpindah antar atom dalam molekul. Resonansi dapat menstabilkan ion konjugat asam, sehingga mempermudah pelepasan proton dan meningkatkan kekuatan asam.
- Konstanta disosiasi asam (Ka): Ka adalah ukuran seberapa banyak asam terdisosiasi dalam larutan. Semakin tinggi nilai Ka, semakin banyak asam yang terdisosiasi, dan semakin kuat asamnya.
Contoh Asam Kuat dan Basa Kuat
Asam kuat adalah asam yang terdisosiasi sepenuhnya dalam larutan, melepaskan semua protonnya. Basa kuat adalah basa yang terdisosiasi sepenuhnya dalam larutan, menerima semua proton yang tersedia. Berikut beberapa contoh asam kuat dan basa kuat berdasarkan teori Brønsted-Lowry:
- Asam kuat: Asam klorida (HCl), asam bromida (HBr), asam iodida (HI), asam perklorat (HClO4), asam nitrat (HNO3), dan asam sulfat (H2SO4).
- Basa kuat: Hidroksida logam alkali (NaOH, KOH, LiOH), hidroksida logam alkali tanah (Ca(OH)2, Ba(OH)2, Sr(OH)2).
Contoh Asam Lemah dan Basa Lemah
Asam lemah hanya terdisosiasi sebagian dalam larutan, tidak semua protonnya dilepaskan. Basa lemah juga hanya terdisosiasi sebagian, tidak semua proton yang tersedia diterima. Berikut beberapa contoh asam lemah dan basa lemah berdasarkan teori Brønsted-Lowry:
- Asam lemah: Asam asetat (CH3COOH), asam karbonat (H2CO3), asam benzoat (C6H5COOH), asam sitrat (C6H8O7).
- Basa lemah: Amonia (NH3), metilamin (CH3NH2), piridin (C5H5N).
Perbedaan Teori Brønsted-Lowry dengan Teori Asam Basa Lainnya
Teori Brønsted-Lowry adalah salah satu teori yang menjelaskan tentang asam dan basa. Teori ini memiliki perbedaan signifikan dengan teori asam basa lainnya, seperti teori Arrhenius dan teori Lewis. Yuk, kita bahas perbedaannya!
Perbedaan Teori Brønsted-Lowry dengan Teori Arrhenius
Teori Arrhenius, yang dikemukakan oleh Svante Arrhenius pada tahun 1884, mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, dan basa sebagai zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Teori ini cukup sederhana dan berhasil menjelaskan banyak reaksi asam-basa, tetapi memiliki keterbatasan. Misalnya, teori ini tidak dapat menjelaskan mengapa amonia (NH3) bersifat basa meskipun tidak mengandung ion hidroksida.
Teori Brønsted-Lowry, yang dikemukakan oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry secara independen pada tahun 1923, memperluas definisi asam dan basa. Menurut teori ini, asam adalah zat yang dapat mendonorkan proton (H+), sedangkan basa adalah zat yang dapat menerima proton. Jadi, teori Brønsted-Lowry lebih umum dan dapat menjelaskan reaksi asam-basa yang tidak dapat dijelaskan oleh teori Arrhenius.
Perbedaan utama antara teori Brønsted-Lowry dan teori Arrhenius terletak pada definisi asam dan basa. Teori Arrhenius hanya fokus pada pembentukan ion H+ dan OH- dalam larutan, sedangkan teori Brønsted-Lowry mempertimbangkan transfer proton.
- Teori Arrhenius hanya berlaku untuk reaksi dalam larutan air, sedangkan teori Brønsted-Lowry berlaku untuk reaksi dalam berbagai pelarut, termasuk pelarut non-air.
- Teori Brønsted-Lowry dapat menjelaskan sifat basa dari amonia (NH3) karena amonia dapat menerima proton untuk membentuk ion amonium (NH4+).
Perbedaan Teori Brønsted-Lowry dengan Teori Lewis
Teori Lewis, yang dikemukakan oleh Gilbert N. Lewis pada tahun 1923, memberikan definisi yang lebih luas lagi tentang asam dan basa. Menurut teori ini, asam adalah zat yang dapat menerima pasangan elektron, sedangkan basa adalah zat yang dapat mendonorkan pasangan elektron. Teori Lewis mencakup lebih banyak reaksi dibandingkan dengan teori Brønsted-Lowry, karena teori Lewis tidak terbatas pada transfer proton.
Perbedaan utama antara teori Brønsted-Lowry dan teori Lewis terletak pada definisi asam dan basa. Teori Brønsted-Lowry fokus pada transfer proton, sedangkan teori Lewis fokus pada transfer pasangan elektron. Teori Lewis lebih umum dan dapat menjelaskan reaksi yang tidak dapat dijelaskan oleh teori Brønsted-Lowry, seperti reaksi antara boron trifluorida (BF3) dan amonia (NH3).
- Teori Lewis mencakup lebih banyak reaksi asam-basa dibandingkan dengan teori Brønsted-Lowry. Misalnya, reaksi antara BF3 dan NH3 adalah reaksi asam-basa Lewis, tetapi bukan reaksi asam-basa Brønsted-Lowry.
- Teori Lewis tidak terbatas pada transfer proton, sehingga dapat menjelaskan reaksi yang melibatkan spesies yang tidak mengandung proton.
Kesimpulan
Teori Brønsted-Lowry memberikan cara pandang yang lebih luas tentang asam basa. Teori ini membantu kita memahami berbagai reaksi kimia yang melibatkan perpindahan proton, dan memberikan kerangka kerja yang konsisten untuk mengklasifikasikan senyawa sebagai asam atau basa.
Poin-poin Penting Teori Brønsted-Lowry
Teori Brønsted-Lowry mendefinisikan asam sebagai donor proton (H+) dan basa sebagai akseptor proton. Dalam reaksi asam basa, asam akan melepaskan proton dan basa akan menerimanya. Hal ini menghasilkan pasangan asam basa konjugat, di mana asam konjugat adalah spesies yang terbentuk setelah asam melepaskan proton, dan basa konjugat adalah spesies yang terbentuk setelah basa menerima proton.
- Asam Brønsted-Lowry adalah donor proton.
- Basa Brønsted-Lowry adalah akseptor proton.
- Setiap asam memiliki basa konjugat yang terbentuk ketika asam melepaskan proton.
- Setiap basa memiliki asam konjugat yang terbentuk ketika basa menerima proton.
Aplikasi Teori Brønsted-Lowry
Teori Brønsted-Lowry memiliki aplikasi yang luas dalam kimia. Berikut beberapa contoh:
- Memahami Reaksi Asam Basa: Teori ini membantu kita memahami reaksi asam basa dalam larutan berair dan non-air. Misalnya, dalam reaksi antara asam klorida (HCl) dan air (H2O), HCl bertindak sebagai asam Brønsted-Lowry karena melepaskan proton, sedangkan air bertindak sebagai basa Brønsted-Lowry karena menerima proton. Reaksi ini menghasilkan ion hidronium (H3O+) dan ion klorida (Cl–).
- Menentukan Kekuatan Asam dan Basa: Teori ini membantu kita menentukan kekuatan relatif asam dan basa berdasarkan kecenderungannya untuk melepaskan atau menerima proton. Asam kuat akan cenderung melepaskan proton sepenuhnya, sedangkan asam lemah hanya akan melepaskan sebagian proton. Demikian pula, basa kuat akan cenderung menerima proton sepenuhnya, sedangkan basa lemah hanya akan menerima sebagian proton.
- Memahami Reaksi Kesetimbangan: Teori ini membantu kita memahami kesetimbangan reaksi asam basa, di mana asam dan basa bereaksi secara bolak-balik untuk membentuk pasangan asam basa konjugat. Kesetimbangan ini dipengaruhi oleh kekuatan relatif asam dan basa yang terlibat.
Kesimpulan
Teori Brønsted-Lowry memberikan pemahaman yang lebih luas tentang sifat asam dan basa, melampaui definisi tradisional. Teori ini membantu kita memahami berbagai reaksi kimia yang terjadi di sekitar kita, dari proses pencernaan hingga industri kimia. Jadi, lain kali kamu merasakan asam jeruk nipis atau sabun yang licin, ingatlah bahwa itu adalah bukti nyata dari teori Brønsted-Lowry!
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru