Jelaskan pengertian asam basa menurut arrhenius – Pernah dengar istilah asam dan basa? Dua istilah ini sering banget kita temui dalam pelajaran kimia. Tapi, sebenarnya apa sih pengertian asam dan basa? Svante Arrhenius, seorang ilmuwan hebat, punya teori sendiri nih tentang asam dan basa. Penasaran? Yuk, kita bahas!
Teori Arrhenius menjelaskan asam sebagai senyawa yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. Sementara itu, basa didefinisikan sebagai senyawa yang menghasilkan ion hidroksida (OH-) dalam air. Sederhana kan? Tapi, jangan salah, teori ini punya banyak aplikasi menarik lho, mulai dari kehidupan sehari-hari hingga bidang industri dan kesehatan.
Definisi Asam Menurut Arrhenius
Pernah dengar istilah asam dan basa? Yap, dua istilah ini merupakan konsep dasar dalam kimia yang menggambarkan sifat suatu zat. Salah satu teori yang menjelaskan tentang asam dan basa adalah teori Arrhenius, yang dikemukakan oleh Svante Arrhenius pada tahun 1884. Teori ini memberikan definisi yang sederhana dan mudah dipahami tentang asam dan basa.
Definisi Asam Menurut Teori Arrhenius
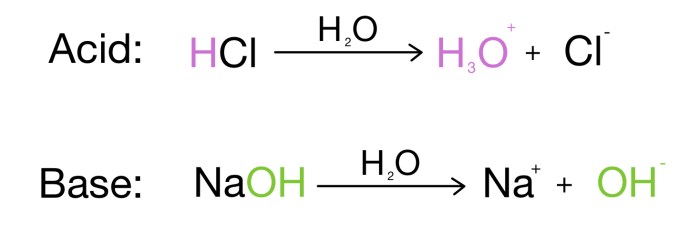
Menurut teori Arrhenius, asam adalah zat yang jika dilarutkan dalam air akan melepaskan ion hidrogen (H+). Sederhananya, asam adalah zat yang memiliki kemampuan untuk meningkatkan konsentrasi ion hidrogen dalam larutan.
Asam + H2O → H+ + Anion
Contohnya, ketika asam klorida (HCl) dilarutkan dalam air, akan melepaskan ion hidrogen (H+) dan ion klorida (Cl-):
HCl + H2O → H+ + Cl–
Contoh Senyawa Asam
Ada banyak senyawa yang termasuk asam berdasarkan teori Arrhenius. Berikut beberapa contohnya:
- Asam klorida (HCl): Asam klorida merupakan asam kuat yang digunakan dalam berbagai industri, seperti pembuatan plastik dan pupuk.
- Asam sulfat (H2SO4): Asam sulfat merupakan asam kuat yang digunakan dalam pembuatan baterai, pupuk, dan bahan peledak.
- Asam nitrat (HNO3): Asam nitrat merupakan asam kuat yang digunakan dalam pembuatan pupuk, bahan peledak, dan bahan kimia lainnya.
- Asam asetat (CH3COOH): Asam asetat merupakan asam lemah yang ditemukan dalam cuka.
- Asam sitrat (C6H8O7): Asam sitrat merupakan asam lemah yang ditemukan dalam buah jeruk.
Perbandingan Teori Arrhenius dengan Teori Asam Basa Lainnya
Teori Arrhenius merupakan teori yang sederhana dan mudah dipahami. Namun, teori ini memiliki beberapa keterbatasan, seperti tidak dapat menjelaskan sifat asam dan basa dari zat yang tidak mengandung ion hidrogen atau hidroksida. Oleh karena itu, muncul teori asam basa lainnya, seperti teori Brønsted-Lowry dan teori Lewis, yang lebih luas dan dapat menjelaskan sifat asam dan basa dengan lebih baik.
| Teori | Definisi Asam | Definisi Basa |
|---|---|---|
| Arrhenius | Zat yang melepaskan ion hidrogen (H+) dalam air | Zat yang melepaskan ion hidroksida (OH-) dalam air |
| Brønsted-Lowry | Donor proton (H+) | Akseptor proton (H+) |
| Lewis | Akseptor pasangan elektron | Donor pasangan elektron |
Definisi Basa Menurut Arrhenius
Oke, udah ngerti kan tentang asam menurut Arrhenius? Sekarang kita bahas tentang definisi basanya. Kayak asam, Arrhenius juga punya definisi tersendiri tentang basa. Sederhananya, Arrhenius ngeliat basa sebagai senyawa yang kalau dilarutkan dalam air, bisa ngeluarin ion hidroksida (OH-)!
Contoh Senyawa Basa Menurut Arrhenius
Nah, biar makin jelas, coba perhatikan beberapa contoh senyawa yang termasuk basa menurut Arrhenius, nih:
- Natrium hidroksida (NaOH): Ini dia basa paling umum yang sering kamu temuin di lab kimia. NaOH kalau dilarutkan dalam air, akan terurai jadi ion natrium (Na+) dan ion hidroksida (OH-).
- Kalium hidroksida (KOH): Mirip sama NaOH, KOH juga bisa ngeluarin ion hidroksida (OH-) ketika dilarutkan dalam air.
- Kalsium hidroksida (Ca(OH)2): Ini nih, basa yang sering digunakan untuk netralisir asam, contohnya di industri pupuk.
- Amonium hidroksida (NH4OH): Meskipun namanya ada ‘hidroksida’, tapi NH4OH sebenarnya basa lemah, dan sering disebut sebagai larutan amonia (NH3) dalam air.
Perbedaan Teori Arrhenius dengan Teori Asam Basa Lainnya
Sekarang, kalau kita bandingkan dengan teori asam basa lainnya, Arrhenius punya beberapa ciri khas yang perlu kamu perhatikan:
| Teori Asam Basa | Definisi Basa | Contoh |
|---|---|---|
| Arrhenius | Senyawa yang menghasilkan ion hidroksida (OH-) ketika dilarutkan dalam air. | NaOH, KOH, Ca(OH)2 |
| Brønsted-Lowry | Senyawa yang menerima proton (H+). | NH3, H2O |
| Lewis | Senyawa yang dapat menerima pasangan elektron. | NH3, OH- |
Ciri-ciri Asam dan Basa Menurut Arrhenius
Oke, udah paham kan tentang definisi asam dan basa menurut Arrhenius? Sekarang kita bahas lebih dalam lagi tentang ciri-ciri asam dan basa yang diajukan oleh Arrhenius ini. Gimana sih cara ngenalin asam dan basa secara mudah? Yuk, kita cari tahu!
Ciri-ciri Asam Menurut Arrhenius
Jadi, menurut Arrhenius, asam adalah zat yang kalau dilarutkan dalam air akan menghasilkan ion hidrogen (H+). Sederhananya, asam itu punya kemampuan untuk melepaskan ion hidrogen. Misalnya, asam klorida (HCl) kalau dilarutkan dalam air akan menghasilkan ion hidrogen (H+) dan ion klorida (Cl–).
- Asam punya rasa masam. Coba deh kamu cicipin jeruk nipis, rasa asamnya itu berasal dari asam sitrat. Tapi hati-hati ya, jangan asal nyobain semua zat yang kamu temuin, karena bisa bahaya!
- Asam bisa mengubah warna lakmus dari biru menjadi merah. Ini adalah salah satu cara paling gampang untuk ngenalin asam. Coba deh kamu tetesin larutan asam ke kertas lakmus biru, nanti warnanya akan berubah jadi merah.
- Asam bisa bereaksi dengan basa dan menghasilkan garam dan air. Reaksi ini disebut dengan reaksi netralisasi. Misalnya, asam klorida (HCl) bereaksi dengan natrium hidroksida (NaOH) akan menghasilkan garam natrium klorida (NaCl) dan air (H2O).
Ciri-ciri Basa Menurut Arrhenius
Nah, kalau basa menurut Arrhenius, itu adalah zat yang kalau dilarutkan dalam air akan menghasilkan ion hidroksida (OH–). Jadi, basa punya kemampuan untuk melepaskan ion hidroksida.
- Basa punya rasa pahit dan licin. Pernah nyobain sabun? Rasanya licin dan pahit kan? Itu karena sabun mengandung basa.
- Basa bisa mengubah warna lakmus dari merah menjadi biru. Kebalikan dari asam, basa bisa mengubah warna lakmus dari merah ke biru.
- Basa bisa bereaksi dengan asam dan menghasilkan garam dan air. Sama seperti asam, basa juga bisa bereaksi dengan asam, dan menghasilkan garam dan air. Reaksi ini juga disebut dengan reaksi netralisasi.
Tabel Ciri-ciri Asam dan Basa
| Ciri-ciri | Asam | Basa |
|---|---|---|
| Rasa | Masam | Pahit |
| Tekstur | – | Licin |
| Warna Lakmus | Merah | Biru |
| Reaksi dengan Air | Membebaskan ion H+ | Membebaskan ion OH– |
| Reaksi dengan Basa | Garam + Air | – |
| Reaksi dengan Asam | – | Garam + Air |
Reaksi Asam Basa Menurut Arrhenius
Oke, balik lagi ke dunia kimia yang seru! Kita udah bahas tentang pengertian asam basa menurut Arrhenius, sekarang kita mau bahas lebih lanjut tentang reaksi asam basa yang terjadi menurut teori Arrhenius. Siap-siap, karena kita bakal ngebongkar rahasia di balik reaksi yang terjadi saat asam dan basa bertemu!
Reaksi Asam Basa Berdasarkan Teori Arrhenius
Teori Arrhenius ngasih kita pandangan tentang asam dan basa yang sederhana, tapi powerful banget. Teori ini bilang, asam adalah zat yang bisa melepaskan ion hidrogen (H+) saat dilarutkan dalam air. Sedangkan basa adalah zat yang bisa melepaskan ion hidroksida (OH-) saat dilarutkan dalam air.
Nah, saat asam dan basa bertemu, terjadi reaksi netralisasi yang menghasilkan garam dan air. Reaksi ini bisa digambarkan sebagai berikut:
Asam + Basa → Garam + Air
Contohnya, saat asam klorida (HCl) dilarutkan dalam air, dia melepaskan ion hidrogen (H+). Dan saat natrium hidroksida (NaOH) dilarutkan dalam air, dia melepaskan ion hidroksida (OH-). Ketika kedua larutan ini bertemu, terjadi reaksi netralisasi yang menghasilkan garam natrium klorida (NaCl) dan air (H2O).
Contoh Reaksi Asam Basa Berdasarkan Teori Arrhenius
Gimana nih, udah mulai kebayang kan? Biar makin jelas, yuk kita lihat beberapa contoh reaksi asam basa menurut Arrhenius. Siap-siap ngecek tabelnya!
| Asam | Basa | Garam | Air |
|---|---|---|---|
| HCl (asam klorida) | NaOH (natrium hidroksida) | NaCl (natrium klorida) | H2O (air) |
| H2SO4 (asam sulfat) | KOH (kalium hidroksida) | K2SO4 (kalium sulfat) | H2O (air) |
| HNO3 (asam nitrat) | Ca(OH)2 (kalsium hidroksida) | Ca(NO3)2 (kalsium nitrat) | H2O (air) |
Gampang banget kan? Nah, sekarang kamu udah bisa ngebayangin reaksi asam basa menurut Arrhenius. Teori ini emang simpel, tapi ngasih kita pemahaman dasar tentang asam basa yang penting banget dalam kimia.
Kekuatan Asam dan Basa Menurut Arrhenius
Oke, kita udah bahas pengertian asam dan basa menurut Arrhenius. Sekarang, gimana kita bisa ngebedain asam dan basa berdasarkan kekuatannya? Tenang, teori Arrhenius juga bisa ngebantu kita untuk ngelompokkin asam dan basa berdasarkan kekuatannya.
Kekuatan Asam dan Basa
Teori Arrhenius ngebagi asam dan basa jadi dua kategori, yaitu asam kuat dan asam lemah, serta basa kuat dan basa lemah. Perbedaannya terletak pada kemampuan mereka untuk melepas ion hidrogen (H+) atau ion hidroksida (OH-) dalam larutan.
Asam Kuat
Asam kuat adalah asam yang terionisasi sempurna dalam larutan, artinya semua molekul asam melepas ion hidrogen (H+) dalam larutan. Contoh asam kuat berdasarkan teori Arrhenius:
- Asam klorida (HCl)
- Asam bromida (HBr)
- Asam iodida (HI)
- Asam nitrat (HNO3)
- Asam perklorat (HClO4)
- Asam sulfat (H2SO4)
Asam Lemah
Asam lemah adalah asam yang hanya terionisasi sebagian dalam larutan, artinya hanya sebagian molekul asam yang melepas ion hidrogen (H+) dalam larutan. Contoh asam lemah berdasarkan teori Arrhenius:
- Asam asetat (CH3COOH)
- Asam karbonat (H2CO3)
- Asam benzoat (C6H5COOH)
- Asam hidrosulfida (H2S)
- Asam fluorida (HF)
Basa Kuat
Basa kuat adalah basa yang terionisasi sempurna dalam larutan, artinya semua molekul basa melepas ion hidroksida (OH-) dalam larutan. Contoh basa kuat berdasarkan teori Arrhenius:
- Natrium hidroksida (NaOH)
- Kalium hidroksida (KOH)
- Litium hidroksida (LiOH)
- Kalsium hidroksida (Ca(OH)2)
- Barium hidroksida (Ba(OH)2)
Basa Lemah
Basa lemah adalah basa yang hanya terionisasi sebagian dalam larutan, artinya hanya sebagian molekul basa yang melepas ion hidroksida (OH-) dalam larutan. Contoh basa lemah berdasarkan teori Arrhenius:
- Amonia (NH3)
- Magnesium hidroksida (Mg(OH)2)
- Aluminium hidroksida (Al(OH)3)
- Kalium karbonat (K2CO3)
- Natrium karbonat (Na2CO3)
Kelebihan dan Kekurangan Teori Arrhenius
Teori Arrhenius, yang diusulkan oleh Svante Arrhenius pada tahun 1884, menjadi salah satu teori awal yang mencoba menjelaskan sifat asam dan basa. Teori ini mengasumsikan bahwa asam adalah zat yang melepaskan ion hidrogen (H+) ketika dilarutkan dalam air, sedangkan basa adalah zat yang melepaskan ion hidroksida (OH-) ketika dilarutkan dalam air. Teori ini memberikan dasar penting untuk memahami reaksi asam-basa, tetapi juga memiliki beberapa keterbatasan. Nah, kali ini kita akan bahas lebih detail tentang kelebihan dan kekurangan teori Arrhenius, yuk!
Sederhananya, teori asam basa Arrhenius menggambarkan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, sementara basa menghasilkan ion hidroksida (OH-). Konsep ini, yang dikemukakan oleh Svante Arrhenius pada tahun 1884, menjadi pondasi pemahaman kita tentang asam basa.
Tapi, konsep ini juga memicu pertanyaan-pertanyaan lebih lanjut tentang sifat asam basa. Mempelajari sejarah perkembangan teori asam basa, seperti yang dirangkum dalam 10 pengertian sejarah menurut para ahli , membantu kita memahami bagaimana ilmu pengetahuan berkembang dan terus mencari penjelasan yang lebih komprehensif.
Teori Arrhenius, meskipun sederhana, tetap menjadi dasar penting dalam mempelajari reaksi kimia dan fenomena asam basa di berbagai bidang, seperti kimia organik dan biokimia.
Kelebihan Teori Arrhenius
Teori Arrhenius memberikan beberapa kelebihan dalam menjelaskan sifat asam dan basa, lho. Kelebihan-kelebihan ini menjadi dasar penting untuk memahami konsep asam-basa dan membuka jalan bagi pengembangan teori-teori asam-basa lainnya. Berikut adalah beberapa kelebihan teori Arrhenius:
- Mudah dipahami dan diaplikasikan. Teori Arrhenius mudah dipahami dan diaplikasikan dalam menjelaskan reaksi asam-basa sederhana. Misalnya, ketika asam klorida (HCl) dilarutkan dalam air, ia melepaskan ion hidrogen (H+) dan ion klorida (Cl-), sehingga larutan tersebut bersifat asam. Begitu pula, ketika natrium hidroksida (NaOH) dilarutkan dalam air, ia melepaskan ion natrium (Na+) dan ion hidroksida (OH-), sehingga larutan tersebut bersifat basa.
- Membantu menjelaskan sifat asam dan basa berdasarkan kemampuan melepaskan ion H+ dan OH-. Teori ini menghubungkan sifat asam dan basa dengan kemampuan zat untuk melepaskan ion hidrogen (H+) dan ion hidroksida (OH-) dalam larutan air. Ini memberikan dasar yang jelas untuk memahami mengapa asam memiliki rasa asam dan basa memiliki rasa pahit.
- Berkontribusi dalam pengembangan teori asam-basa lainnya. Teori Arrhenius menjadi landasan bagi pengembangan teori asam-basa lainnya, seperti teori Brønsted-Lowry dan teori Lewis. Teori-teori ini memperluas konsep asam-basa dan menjelaskan reaksi asam-basa yang tidak dapat dijelaskan oleh teori Arrhenius.
Kekurangan Teori Arrhenius
Meskipun teori Arrhenius memiliki beberapa kelebihan, teori ini juga memiliki beberapa kekurangan yang membatasi kemampuannya dalam menjelaskan semua reaksi asam-basa. Berikut adalah beberapa kekurangan teori Arrhenius:
- Hanya berlaku untuk reaksi asam-basa dalam larutan air. Teori Arrhenius hanya berlaku untuk reaksi asam-basa yang terjadi dalam larutan air. Teori ini tidak dapat menjelaskan reaksi asam-basa yang terjadi dalam pelarut non-air, seperti amonia cair atau aseton.
- Tidak dapat menjelaskan sifat asam dan basa zat yang tidak melepaskan ion H+ atau OH-. Teori Arrhenius tidak dapat menjelaskan sifat asam dan basa zat yang tidak melepaskan ion hidrogen (H+) atau ion hidroksida (OH-) dalam larutan air. Misalnya, amonia (NH3) bersifat basa meskipun tidak melepaskan ion hidroksida (OH-) dalam larutan air.
- Tidak dapat menjelaskan reaksi asam-basa yang melibatkan senyawa organik. Teori Arrhenius tidak dapat menjelaskan reaksi asam-basa yang melibatkan senyawa organik, seperti asam karboksilat dan amina. Senyawa-senyawa ini tidak selalu melepaskan ion hidrogen (H+) atau ion hidroksida (OH-) dalam larutan air.
Perbandingan Teori Arrhenius dengan Teori Asam-Basa Lainnya
Teori Arrhenius, Brønsted-Lowry, dan Lewis adalah tiga teori utama yang menjelaskan sifat asam dan basa. Berikut adalah tabel perbandingan ketiga teori tersebut:
| Teori | Definisi Asam | Definisi Basa | Kelebihan | Kekurangan |
|---|---|---|---|---|
| Arrhenius | Zat yang melepaskan ion H+ dalam larutan air | Zat yang melepaskan ion OH- dalam larutan air | Mudah dipahami dan diaplikasikan | Hanya berlaku untuk reaksi asam-basa dalam larutan air |
| Brønsted-Lowry | Donor proton (H+) | Akseptor proton (H+) | Lebih luas, dapat menjelaskan reaksi asam-basa dalam pelarut non-air | Tidak dapat menjelaskan reaksi asam-basa yang tidak melibatkan transfer proton |
| Lewis | Akseptor pasangan elektron | Donor pasangan elektron | Paling luas, dapat menjelaskan semua reaksi asam-basa, termasuk reaksi yang tidak melibatkan transfer proton | Lebih kompleks dan abstrak |
Perkembangan Teori Asam Basa
Teori Arrhenius tentang asam basa, yang menjelaskan bahwa asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan, dan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan, adalah titik awal yang penting dalam pemahaman kita tentang sifat kimia. Namun, teori ini memiliki keterbatasan dalam menjelaskan sifat asam basa dari beberapa senyawa. Seiring berjalannya waktu, para ilmuwan mengembangkan teori-teori baru yang lebih komprehensif untuk menjelaskan fenomena asam basa yang lebih luas.
Teori Brønsted-Lowry
Teori Brønsted-Lowry, yang dikemukakan oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry secara independen pada tahun 1923, memperluas definisi asam basa dengan mempertimbangkan pertukaran proton (ion hidrogen) dalam reaksi kimia. Menurut teori ini, asam adalah zat yang dapat mendonorkan proton, sedangkan basa adalah zat yang dapat menerima proton.
- Contohnya, dalam reaksi antara asam klorida (HCl) dan air (H2O), HCl mendonorkan proton ke H2O, membentuk ion hidronium (H3O+) dan ion klorida (Cl-):
HCl + H2O → H3O+ + Cl-
- Dalam reaksi ini, HCl bertindak sebagai asam karena mendonorkan proton, sedangkan H2O bertindak sebagai basa karena menerima proton.
Teori Lewis
Teori Lewis, yang dikemukakan oleh Gilbert Newton Lewis pada tahun 1923, memberikan definisi asam basa yang lebih luas lagi. Menurut teori ini, asam adalah zat yang dapat menerima pasangan elektron, sedangkan basa adalah zat yang dapat mendonorkan pasangan elektron.
- Contohnya, dalam reaksi antara boron trifluorida (BF3) dan amonia (NH3), BF3 menerima pasangan elektron dari NH3, membentuk senyawa adduct BF3-NH3:
BF3 + NH3 → BF3-NH3
- Dalam reaksi ini, BF3 bertindak sebagai asam Lewis karena menerima pasangan elektron, sedangkan NH3 bertindak sebagai basa Lewis karena mendonorkan pasangan elektron.
Perbedaan Teori Asam Basa
| Teori | Definisi Asam | Definisi Basa | Contoh |
|---|---|---|---|
| Arrhenius | Zat yang menghasilkan ion hidrogen (H+) dalam larutan | Zat yang menghasilkan ion hidroksida (OH-) dalam larutan | HCl, HNO3, NaOH, KOH |
| Brønsted-Lowry | Zat yang dapat mendonorkan proton | Zat yang dapat menerima proton | HCl, H2SO4, NH3, H2O |
| Lewis | Zat yang dapat menerima pasangan elektron | Zat yang dapat mendonorkan pasangan elektron | BF3, AlCl3, NH3, H2O |
Aplikasi Teori Arrhenius dalam Kimia: Jelaskan Pengertian Asam Basa Menurut Arrhenius
Teori Arrhenius, yang dikemukakan oleh Svante Arrhenius pada tahun 1884, memberikan penjelasan tentang sifat asam dan basa. Teori ini mendasari banyak konsep kimia modern, dan penerapannya sangat luas, mulai dari analisis kimia hingga sintesis organik. Teori ini membantu kita memahami bagaimana asam dan basa bereaksi, membentuk garam, dan memengaruhi kesetimbangan reaksi. Berikut ini beberapa contoh aplikasi teori Arrhenius dalam bidang kimia.
Kimia Analitik
Teori Arrhenius memiliki peran penting dalam kimia analitik, terutama dalam titrasi asam-basa. Titrasi adalah metode kuantitatif yang digunakan untuk menentukan konsentrasi suatu zat dengan menggunakan reaksi kimia yang diketahui. Dalam titrasi asam-basa, teori Arrhenius membantu kita memahami bagaimana asam dan basa bereaksi untuk menghasilkan garam dan air.
- Contohnya, dalam titrasi asam kuat seperti HCl dengan basa kuat seperti NaOH, reaksi yang terjadi adalah:
- Reaksi ini menghasilkan garam NaCl dan air. Teori Arrhenius menjelaskan bahwa HCl melepaskan ion hidrogen (H+) dalam larutan, sedangkan NaOH melepaskan ion hidroksida (OH–). Ion-ion ini kemudian bereaksi untuk membentuk air, sedangkan ion-ion yang tersisa membentuk garam.
- Dengan memahami reaksi ini, kita dapat menentukan konsentrasi asam atau basa yang tidak diketahui dengan menggunakan larutan standar asam atau basa.
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Kimia Organik
Teori Arrhenius juga memiliki aplikasi dalam kimia organik, terutama dalam memahami reaksi asam-basa yang melibatkan senyawa organik. Senyawa organik mengandung karbon dan seringkali memiliki gugus fungsi yang dapat bertindak sebagai asam atau basa.
- Contohnya, asam karboksilat seperti asam asetat (CH3COOH) adalah asam lemah yang dapat melepaskan ion hidrogen (H+) dalam larutan.
- Teori Arrhenius membantu kita memahami bahwa asam karboksilat dapat bereaksi dengan basa untuk membentuk garam dan air. Misalnya, asam asetat dapat bereaksi dengan NaOH untuk membentuk natrium asetat (CH3COONa) dan air.
- Reaksi ini penting dalam berbagai proses kimia organik, seperti sintesis ester dan amida.
CH3COOH(aq) ⇌ CH3COO–(aq) + H+(aq)
Kimia Anorganik
Teori Arrhenius juga memiliki aplikasi dalam kimia anorganik, terutama dalam memahami sifat asam dan basa dari senyawa anorganik. Senyawa anorganik biasanya tidak mengandung karbon dan memiliki struktur yang beragam.
- Contohnya, asam sulfat (H2SO4) adalah asam kuat yang dapat melepaskan dua ion hidrogen (H+) dalam larutan.
- Teori Arrhenius membantu kita memahami bahwa asam sulfat dapat bereaksi dengan basa untuk membentuk garam dan air. Misalnya, asam sulfat dapat bereaksi dengan NaOH untuk membentuk natrium sulfat (Na2SO4) dan air.
- Reaksi ini penting dalam berbagai proses kimia anorganik, seperti produksi pupuk, pembuatan asam, dan pemurnian logam.
H2SO4(aq) → 2H+(aq) + SO42-(aq)
Ilustrasi Teori Arrhenius
Teori Arrhenius memberikan pemahaman dasar tentang asam dan basa. Teori ini menjelaskan bagaimana asam dan basa bereaksi dan bagaimana kekuatannya dapat diukur. Untuk memahami teori ini lebih dalam, yuk kita simak beberapa ilustrasi berikut!
Ilustrasi Definisi Asam dan Basa
Teori Arrhenius mendefinisikan asam sebagai senyawa yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. Contohnya, asam klorida (HCl) ketika dilarutkan dalam air akan terionisasi menjadi ion hidrogen (H+) dan ion klorida (Cl-).
HCl(aq) → H+(aq) + Cl-(aq)
Ilustrasi ini menunjukkan bahwa asam klorida melepaskan ion hidrogen (H+) ketika dilarutkan dalam air.
Sementara itu, basa menurut Arrhenius adalah senyawa yang menghasilkan ion hidroksida (OH-) ketika dilarutkan dalam air. Misalnya, natrium hidroksida (NaOH) ketika dilarutkan dalam air akan terionisasi menjadi ion natrium (Na+) dan ion hidroksida (OH-).
NaOH(aq) → Na+(aq) + OH-(aq)
Ilustrasi ini menunjukkan bahwa natrium hidroksida melepaskan ion hidroksida (OH-) ketika dilarutkan dalam air.
Reaksi asam basa menurut Arrhenius terjadi ketika ion hidrogen (H+) dari asam bereaksi dengan ion hidroksida (OH-) dari basa membentuk air (H2O).
H+(aq) + OH-(aq) → H2O(l)
Sebagai contoh, ketika asam klorida (HCl) direaksikan dengan natrium hidroksida (NaOH), akan terjadi reaksi netralisasi yang menghasilkan garam natrium klorida (NaCl) dan air (H2O).
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Ilustrasi ini menunjukkan bahwa reaksi asam basa menghasilkan air dan garam.
Ilustrasi Kekuatan Asam dan Basa
Kekuatan asam dan basa diukur berdasarkan kemampuannya untuk melepaskan ion hidrogen (H+) atau ion hidroksida (OH-) dalam larutan.
Asam kuat seperti asam klorida (HCl) akan terionisasi sepenuhnya dalam larutan, sehingga melepaskan semua ion hidrogen (H+).
Asam lemah seperti asam asetat (CH3COOH) hanya terionisasi sebagian dalam larutan, sehingga melepaskan sedikit ion hidrogen (H+).
Begitu pula dengan basa. Basa kuat seperti natrium hidroksida (NaOH) akan terionisasi sepenuhnya dalam larutan, sehingga melepaskan semua ion hidroksida (OH-).
Basa lemah seperti amonia (NH3) hanya terionisasi sebagian dalam larutan, sehingga melepaskan sedikit ion hidroksida (OH-).
Semakin banyak ion hidrogen (H+) atau ion hidroksida (OH-) yang dilepaskan, semakin kuat asam atau basa tersebut.
Kesimpulan
Teori Arrhenius memang punya beberapa kekurangan, tapi tetap menjadi dasar penting dalam memahami sifat asam dan basa. Teori ini membuka jalan bagi pengembangan teori-teori asam basa yang lebih komprehensif. Jadi, meskipun teori Arrhenius punya keterbatasan, tetap penting untuk dipelajari dan dipahami karena menjadi pondasi untuk memahami kimia asam basa yang lebih luas.
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru