Pengertian asam dan basa menurut bronsted lowry – Pernahkah kamu bertanya-tanya apa yang membuat cuka terasa asam dan sabun terasa licin? Jawabannya terletak pada konsep asam dan basa, yang telah dipelajari sejak lama. Namun, bagaimana sebenarnya asam dan basa bekerja? Teori Brønsted-Lowry hadir untuk menjawab pertanyaan ini, memberikan pemahaman yang lebih mendalam tentang sifat kimiawi kedua zat ini.
Teori Brønsted-Lowry, yang dikemukakan oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923, mendefinisikan asam dan basa berdasarkan kemampuannya untuk menerima atau melepaskan proton (ion hidrogen, H+). Teori ini membuka cakrawala baru dalam memahami reaksi asam basa, memperluas pemahaman kita tentang reaksi kimia yang terjadi di sekitar kita.
Pengertian Asam dan Basa
Asam dan basa, dua istilah yang sering kita dengar dalam pelajaran kimia. Tapi, sebenarnya apa sih pengertiannya? Apa yang membedakan keduanya? Dalam kimia, asam dan basa merupakan zat yang memiliki sifat khas dan berperan penting dalam berbagai reaksi kimia. Untuk memahami sifat-sifatnya, kita perlu mempelajari beberapa teori yang menjelaskan karakteristik asam dan basa.
Salah satu teori yang terkenal adalah teori Brønsted-Lowry, yang memberikan perspektif yang berbeda tentang asam dan basa dibandingkan dengan teori sebelumnya. Teori ini menjelaskan interaksi antara asam dan basa berdasarkan pertukaran proton (ion hidrogen, H+).
Teori Asam Basa Sebelum Brønsted-Lowry
Sebelum teori Brønsted-Lowry muncul, beberapa teori telah mencoba menjelaskan sifat asam dan basa. Berikut beberapa teori yang mendahului teori Brønsted-Lowry:
- Teori Arrhenius: Teori ini mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, dan basa sebagai zat yang menghasilkan ion hidroksida (OH-) dalam larutan.
- Teori Lewis: Teori ini lebih luas, mendefinisikan asam sebagai zat yang menerima pasangan elektron, dan basa sebagai zat yang mendonorkan pasangan elektron.
Tujuan Pembahasan Teori Brønsted-Lowry
Pembahasan tentang teori Brønsted-Lowry bertujuan untuk memberikan pemahaman yang lebih dalam tentang sifat asam dan basa. Teori ini membantu kita untuk:
- Memahami mekanisme reaksi asam-basa yang melibatkan transfer proton.
- Mengenali asam dan basa dalam berbagai reaksi kimia.
- Menjelaskan konsep keasaman dan kebasaan dalam berbagai larutan.
Teori Brønsted-Lowry: Pengertian Asam Dan Basa Menurut Bronsted Lowry
Kamu pasti udah familiar kan sama asam dan basa? Tapi, pernah nggak sih kepikiran, gimana sih cara ngebedain asam dan basa secara ilmiah? Nah, di sini kita akan bahas teori Brønsted-Lowry, salah satu teori yang bisa bantu kita memahami asam dan basa dengan lebih dalam.
Definisi Asam dan Basa Brønsted-Lowry
Teori Brønsted-Lowry, yang dicetuskan oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry secara independen pada tahun 1923, punya definisi asam dan basa yang berbeda dari teori Arrhenius yang udah kamu pelajari sebelumnya. Teori Brønsted-Lowry lebih fokus pada perpindahan proton (H+) dalam reaksi kimia.
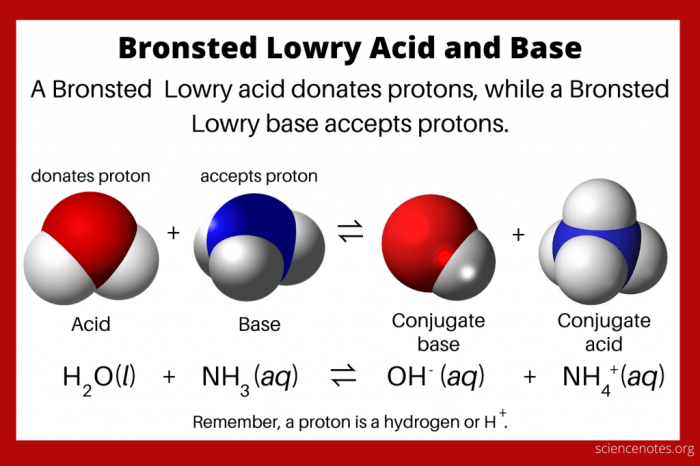
Menurut Brønsted-Lowry, asam adalah zat yang bisa mendonorkan proton (H+), sedangkan basa adalah zat yang bisa menerima proton (H+).
Konsep asam dan basa menurut Brønsted-Lowry mungkin terlihat rumit, tapi sebenarnya sederhana: asam adalah donor proton (H+), sedangkan basa adalah penerima proton. Mirip seperti konsep globalisasi, yang menurut Selo Soemardjan , adalah proses penyebaran ide dan budaya antar negara, yang akhirnya menghasilkan interaksi dan saling ketergantungan antar masyarakat.
Dalam konteks asam-basa, interaksi ini terjadi pada level molekul, di mana proton berpindah dari asam ke basa, membentuk ikatan baru.
Asam: Donor proton (H+)
Basa: Akseptor proton (H+)
Contoh Reaksi Asam Basa Brønsted-Lowry
Untuk lebih ngerti, yuk kita lihat contoh reaksi asam basa berdasarkan teori Brønsted-Lowry:
Misalnya, reaksi antara asam klorida (HCl) dengan air (H2O):
HCl(aq) + H2O(l) → H3O+(aq) + Cl-(aq)
Dalam reaksi ini, HCl mendonorkan proton (H+) ke H2O. Jadi, HCl bertindak sebagai asam, sedangkan H2O bertindak sebagai basa.
Hasil dari reaksi ini adalah ion hidronium (H3O+) dan ion klorida (Cl-). Ion hidronium terbentuk karena H2O menerima proton dari HCl.
Perbedaan Asam dan Basa Brønsted-Lowry
Nah, buat ngebedain asam dan basa menurut Brønsted-Lowry, bisa dilihat dari tabel ini:
| Asam | Basa |
|---|---|
| Donor proton (H+) | Akseptor proton (H+) |
| Memiliki atom hidrogen yang dapat dilepas | Memiliki pasangan elektron bebas yang dapat menerima proton |
| Contoh: HCl, H2SO4, HNO3 | Contoh: NH3, OH-, H2O |
Konsep Asam dan Basa Konjugat
Konsep asam dan basa konjugat adalah inti dari teori Brønsted-Lowry. Teori ini memandang reaksi asam-basa sebagai transfer proton (H+) antara spesies kimia. Nah, dalam pertukaran ini, muncullah pasangan asam-basa konjugat, yang punya peran penting dalam memahami bagaimana reaksi asam-basa berlangsung.
Pengertian Asam dan Basa Konjugat
Asam konjugat adalah spesies yang terbentuk ketika basa menerima proton (H+). Sementara basa konjugat adalah spesies yang terbentuk ketika asam melepaskan proton (H+).
Intinya, asam dan basa konjugat merupakan pasangan yang saling terkait, di mana keduanya berbeda satu proton. Hubungan ini penting karena membantu kita memahami bagaimana reaksi asam-basa berlangsung dan bagaimana perubahan keasaman atau kebasaan suatu larutan.
Contoh Pasangan Asam-Basa Konjugat
Berikut beberapa contoh pasangan asam-basa konjugat yang mudah dipahami:
- Asam: HCl (Asam klorida) Basa Konjugat: Cl- (Ion klorida)
- Asam: H2O (Air) Basa Konjugat: OH- (Ion hidroksida)
- Asam: NH4+ (Ion amonium) Basa Konjugat: NH3 (Amonia)
Perhatikan bahwa dalam setiap contoh, asam dan basa konjugatnya hanya berbeda satu proton (H+). Misalnya, asam klorida (HCl) melepaskan satu proton untuk menjadi ion klorida (Cl-), yang merupakan basa konjugatnya.
Peran Pasangan Asam-Basa Konjugat dalam Reaksi Asam-Basa
Pasangan asam-basa konjugat memainkan peran penting dalam menentukan arah reaksi asam-basa. Perhatikan contoh berikut:
HCl (aq) + H2O (l) ⇌ H3O+ (aq) + Cl- (aq)
Dalam reaksi ini, asam klorida (HCl) bertindak sebagai asam, melepaskan proton (H+) dan membentuk ion klorida (Cl-) sebagai basa konjugatnya. Air (H2O) bertindak sebagai basa, menerima proton (H+) dan membentuk ion hidronium (H3O+) sebagai asam konjugatnya.
Kemampuan suatu spesies untuk bertindak sebagai asam atau basa tergantung pada kekuatan relatifnya dalam melepaskan atau menerima proton. Dalam reaksi ini, HCl adalah asam kuat, sementara H2O adalah basa lemah. Hal ini menyebabkan reaksi bergeser ke kanan, membentuk lebih banyak ion hidronium (H3O+), sehingga larutan menjadi lebih asam.
Kekuatan Asam dan Basa
Oke, udah ngerti kan konsep asam dan basa menurut Brønsted-Lowry? Sekarang kita bahas tentang kekuatan asam dan basa, yang kayaknya lebih seru lagi nih! Soalnya, kekuatan asam dan basa itu ngaruh banget ke sifat dan reaksi kimia.
Faktor-faktor yang Memengaruhi Kekuatan Asam dan Basa
Kekuatan asam dan basa itu bukannya cuma “kuat” atau “lemah” aja, lho. Ada gradasi-gradasi kekuatannya, dan itu dipengaruhi beberapa faktor, antara lain:
- Ikatan kimia: Ikatan antara atom hidrogen (H) dan atom lainnya dalam asam itu berpengaruh besar. Semakin lemah ikatannya, semakin mudah hidrogen lepas, dan asamnya makin kuat.
- Polaritas: Polaritas molekul asam juga ngaruh. Semakin polar molekulnya, semakin mudah hidrogen lepas, dan asamnya makin kuat.
- Ukuran atom: Ukuran atom dalam asam juga berpengaruh. Semakin besar ukuran atom, semakin lemah ikatannya, dan asamnya makin kuat.
- Efek induksi: Adanya gugus atom lain di sekitar atom pusat dalam asam juga bisa memengaruhi kekuatannya. Gugus yang menarik elektron (gugus penarik elektron) akan membuat ikatan H lebih kuat, dan asamnya lebih lemah. Sebaliknya, gugus yang mendorong elektron (gugus pendonor elektron) akan membuat ikatan H lebih lemah, dan asamnya lebih kuat.
Contoh Asam Kuat dan Basa Kuat
Nah, asam kuat dan basa kuat itu biasanya mudah banget ngelepas ion hidrogen (H+) atau ion hidroksida (OH-) dalam larutan. Jadi, di dalam larutan, asam kuat dan basa kuat akan terionisasi sempurna.
- Asam kuat: HCl (asam klorida), HBr (asam bromida), HI (asam iodida), HNO3 (asam nitrat), H2SO4 (asam sulfat), HClO4 (asam perklorat).
- Basa kuat: NaOH (natrium hidroksida), KOH (kalium hidroksida), LiOH (litium hidroksida), Ca(OH)2 (kalsium hidroksida), Sr(OH)2 (stronsium hidroksida), Ba(OH)2 (barium hidroksida).
Contoh Asam Lemah dan Basa Lemah
Berbeda dengan asam kuat dan basa kuat, asam lemah dan basa lemah itu cuma terionisasi sebagian dalam larutan. Jadi, nggak semua molekulnya terurai jadi ion.
- Asam lemah: CH3COOH (asam asetat), H2CO3 (asam karbonat), H3PO4 (asam fosfat), HF (asam fluorida), HNO2 (asam nitrit).
- Basa lemah: NH3 (amonia), CH3NH2 (metilamine), C5H5N (piridin), HCO3- (ion bikarbonat).
Penerapan Teori Brønsted-Lowry
Teori Brønsted-Lowry, yang menggambarkan asam dan basa berdasarkan kemampuan mereka untuk menerima atau melepaskan proton, memiliki aplikasi yang luas dalam berbagai bidang, mulai dari kimia sehari-hari hingga proses industri yang kompleks. Teori ini membantu kita memahami bagaimana reaksi asam basa terjadi dan bagaimana mereka memengaruhi lingkungan kita.
Penerapan dalam Kehidupan Sehari-hari
Teori Brønsted-Lowry membantu kita memahami reaksi asam basa yang terjadi dalam kehidupan sehari-hari. Misalnya, ketika kita minum minuman berkarbonasi, kita sebenarnya sedang mengonsumsi larutan asam karbonat (H2CO3). Asam karbonat merupakan asam lemah yang dalam air akan melepaskan proton (H+) dan membentuk ion bikarbonat (HCO3-) yang memiliki sifat basa.
- Contoh lain adalah penggunaan sabun. Sabun adalah garam asam lemak yang dapat bertindak sebagai basa. Ketika sabun bercampur dengan air, ia akan melepaskan ion hidroksida (OH-) yang membuat larutan menjadi basa. Hal ini membantu membersihkan kotoran dan minyak yang bersifat asam.
Penerapan dalam Tubuh Manusia
Reaksi asam basa sangat penting dalam tubuh manusia. Misalnya, pencernaan makanan melibatkan asam lambung (HCl) yang membantu memecah makanan.
- Dalam darah, terdapat sistem penyangga (buffer) yang menjaga pH darah tetap stabil. Sistem penyangga ini terdiri dari asam lemah dan basa konjugatnya. Salah satu contohnya adalah sistem penyangga bikarbonat (H2CO3/HCO3-) yang membantu menjaga pH darah tetap di sekitar 7,4.
Penerapan dalam Industri
Teori Brønsted-Lowry memiliki aplikasi yang luas dalam industri.
- Dalam industri kimia, reaksi asam basa digunakan dalam berbagai proses sintesis, seperti pembuatan pupuk, obat-obatan, dan bahan kimia lainnya.
- Dalam industri makanan, asam digunakan untuk mengatur pH makanan, menambahkan rasa, dan mencegah pertumbuhan bakteri.
- Dalam industri tekstil, asam digunakan untuk mewarnai kain dan kulit.
Perbedaan Teori Brønsted-Lowry dengan Teori Lainnya
Teori Brønsted-Lowry merupakan salah satu teori asam basa yang paling umum digunakan. Teori ini menawarkan perspektif yang lebih luas tentang asam dan basa dibandingkan dengan teori Arrhenius. Namun, ada juga teori lain yang perlu kamu ketahui, yaitu teori asam basa Lewis. Nah, untuk memahami perbedaan ketiga teori ini, simak penjelasan berikut!
Perbedaan Teori Brønsted-Lowry dengan Teori Arrhenius
Teori Brønsted-Lowry memperluas konsep asam dan basa yang dikemukakan oleh Arrhenius. Teori Arrhenius mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) dalam larutan, sedangkan basa menghasilkan ion hidroksida (OH-). Teori Brønsted-Lowry, di sisi lain, mendefinisikan asam sebagai zat yang dapat mendonorkan proton (H+) dan basa sebagai zat yang dapat menerima proton.
- Teori Arrhenius hanya berlaku dalam larutan berair, sedangkan teori Brønsted-Lowry berlaku dalam berbagai pelarut, termasuk larutan non-air.
- Teori Arrhenius hanya melibatkan ion hidrogen (H+) dan ion hidroksida (OH-), sedangkan teori Brønsted-Lowry mencakup semua zat yang dapat mendonorkan atau menerima proton.
- Contohnya, NH3 (amonia) dapat bertindak sebagai basa menurut teori Brønsted-Lowry karena dapat menerima proton, tetapi tidak dapat dianggap sebagai basa menurut teori Arrhenius karena tidak menghasilkan ion hidroksida dalam larutan.
Perbedaan Teori Brønsted-Lowry dengan Teori Lewis
Teori Lewis memberikan definisi asam dan basa yang lebih luas lagi dibandingkan dengan teori Brønsted-Lowry. Teori Lewis mendefinisikan asam sebagai zat yang dapat menerima pasangan elektron, dan basa sebagai zat yang dapat mendonorkan pasangan elektron.
- Teori Brønsted-Lowry hanya fokus pada transfer proton, sedangkan teori Lewis mencakup transfer pasangan elektron.
- Teori Lewis dapat menjelaskan reaksi asam-basa yang tidak melibatkan proton, seperti reaksi antara boron trifluorida (BF3) dan amonia (NH3), dimana BF3 menerima pasangan elektron dari NH3.
- Teori Lewis juga dapat menjelaskan reaksi asam-basa dalam pelarut non-air, seperti reaksi antara trimetilaluminium (Al(CH3)3) dan dietil eter (Et2O), dimana Al(CH3)3 menerima pasangan elektron dari Et2O.
Perbandingan Ketiga Teori Asam Basa
| Teori | Definisi Asam | Definisi Basa | Contoh |
|---|---|---|---|
| Arrhenius | Zat yang menghasilkan ion hidrogen (H+) dalam larutan | Zat yang menghasilkan ion hidroksida (OH-) dalam larutan | HCl, HNO3, NaOH, KOH |
| Brønsted-Lowry | Zat yang dapat mendonorkan proton (H+) | Zat yang dapat menerima proton (H+) | HCl, HNO3, NH3, H2O |
| Lewis | Zat yang dapat menerima pasangan elektron | Zat yang dapat mendonorkan pasangan elektron | BF3, AlCl3, NH3, H2O |
Kelebihan dan Kekurangan Teori Brønsted-Lowry
Teori Brønsted-Lowry adalah salah satu teori penting dalam kimia yang menjelaskan sifat asam dan basa. Teori ini memberikan pemahaman yang lebih luas tentang reaksi asam basa dibandingkan dengan teori Arrhenius. Tapi, seperti teori lainnya, teori Brønsted-Lowry juga punya kelebihan dan kekurangannya masing-masing. Nah, kali ini kita akan membahas lebih lanjut mengenai kelebihan dan kekurangan teori Brønsted-Lowry.
Kelebihan Teori Brønsted-Lowry
Teori Brønsted-Lowry memiliki beberapa kelebihan yang membuatnya lebih unggul dalam menjelaskan reaksi asam basa, dibandingkan dengan teori Arrhenius. Berikut beberapa kelebihannya:
- Teori Brønsted-Lowry dapat menjelaskan reaksi asam basa dalam berbagai pelarut, tidak hanya dalam air. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry dapat menjelaskan reaksi asam basa yang melibatkan zat yang tidak mengandung ion hidrogen (H+) atau ion hidroksida (OH–). Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry dapat menjelaskan reaksi asam basa yang melibatkan zat yang tidak mengandung ion hidrogen (H+) atau ion hidroksida (OH–). Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry dapat menjelaskan reaksi asam basa yang melibatkan zat yang tidak mengandung ion hidrogen (H+) atau ion hidroksida (OH–). Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry dapat menjelaskan reaksi asam basa yang melibatkan zat yang tidak mengandung ion hidrogen (H+) atau ion hidroksida (OH–). Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry dapat menjelaskan reaksi asam basa yang melibatkan zat yang tidak mengandung ion hidrogen (H+) atau ion hidroksida (OH–). Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry dapat menjelaskan reaksi asam basa yang melibatkan zat yang tidak mengandung ion hidrogen (H+) atau ion hidroksida (OH–). Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
Kekurangan Teori Brønsted-Lowry
Meskipun memiliki banyak kelebihan, teori Brønsted-Lowry juga memiliki beberapa kekurangan, antara lain:
- Teori Brønsted-Lowry tidak dapat menjelaskan semua reaksi asam basa. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry tidak dapat menjelaskan semua reaksi asam basa. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry tidak dapat menjelaskan semua reaksi asam basa. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry tidak dapat menjelaskan semua reaksi asam basa. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry tidak dapat menjelaskan semua reaksi asam basa. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry tidak dapat menjelaskan semua reaksi asam basa. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
- Teori Brønsted-Lowry tidak dapat menjelaskan semua reaksi asam basa. Misalnya, reaksi antara asam klorida (HCl) dengan amonia (NH3) dalam pelarut aseton.
Contoh Soal dan Pembahasan
Nah, sekarang kamu sudah paham konsep Brønsted-Lowry. Saatnya kita coba latihan soal biar makin mantap. Di sini, kita akan bahas dua jenis soal: yang pertama tentang teori Brønsted-Lowry itu sendiri, dan yang kedua tentang kekuatan asam dan basa.
Contoh Soal tentang Teori Brønsted-Lowry
Soal-soal tentang teori Brønsted-Lowry biasanya menanyakan tentang identifikasi asam dan basa, atau pasangan asam-basa konjugat dalam reaksi kimia.
- Contoh Soal 1: Tentukan asam dan basa Brønsted-Lowry dalam reaksi berikut:
HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl–(aq)
- Pembahasan:
- Dalam reaksi ini, HCl melepaskan ion H+ dan menjadi Cl–. Jadi, HCl berperan sebagai asam Brønsted-Lowry.
- H2O menerima ion H+ dan menjadi H3O+. Jadi, H2O berperan sebagai basa Brønsted-Lowry.
- Pasangan asam-basa konjugat dalam reaksi ini adalah:
- HCl dan Cl–
- H2O dan H3O+
Contoh Soal tentang Kekuatan Asam dan Basa
Soal-soal tentang kekuatan asam dan basa biasanya menanyakan tentang kekuatan relatif asam atau basa, atau tentang pengaruh struktur molekul terhadap kekuatan asam atau basa.
- Contoh Soal 2: Manakah yang lebih kuat: asam asetat (CH3COOH) atau asam klorida (HCl)? Jelaskan!
- Pembahasan:
- HCl merupakan asam kuat, sedangkan CH3COOH merupakan asam lemah.
- Kekuatan asam ditentukan oleh kemampuannya untuk melepaskan ion H+. HCl memiliki ikatan H-Cl yang lebih polar dibandingkan dengan ikatan H-O dalam CH3COOH.
- Ikatan H-Cl yang lebih polar membuat HCl lebih mudah melepaskan ion H+ dibandingkan dengan CH3COOH, sehingga HCl merupakan asam yang lebih kuat.
Aplikasi Teori Brønsted-Lowry dalam Kimia
Teori Brønsted-Lowry, yang menjelaskan asam dan basa berdasarkan kemampuannya untuk menyumbangkan atau menerima proton (H+), memiliki aplikasi yang luas dalam berbagai bidang kimia. Teori ini memberikan kerangka kerja yang kuat untuk memahami reaksi asam-basa dan perilakunya dalam berbagai sistem kimia.
Teori Brønsted-Lowry merupakan fondasi dalam kimia analitik, khususnya dalam titrasi asam-basa. Titrasi adalah teknik yang digunakan untuk menentukan konsentrasi zat terlarut dengan mereaksikan dengan larutan standar yang konsentrasinya diketahui.
- Dalam titrasi asam-basa, teori Brønsted-Lowry membantu kita memahami bagaimana asam dan basa bereaksi, dan bagaimana perubahan pH selama titrasi.
- Titrasi asam-basa melibatkan reaksi antara asam dan basa, dan titik ekivalen dicapai ketika jumlah ekivalen asam dan basa sama.
- Dengan memahami konsep asam dan basa menurut Brønsted-Lowry, kita dapat menentukan titik ekivalen dengan lebih akurat, sehingga membantu kita menentukan konsentrasi zat terlarut dengan lebih tepat.
Kimia Organik
Teori Brønsted-Lowry sangat penting dalam memahami reaksi kimia organik, khususnya reaksi yang melibatkan gugus fungsi yang bersifat asam atau basa.
- Contohnya, reaksi adisi elektrofilik, yang melibatkan serangan elektrofil pada ikatan rangkap, seringkali dipengaruhi oleh keberadaan gugus fungsi asam atau basa.
- Teori Brønsted-Lowry membantu kita memahami bagaimana gugus fungsi ini berinteraksi dengan elektrofil dan nukleofil, dan bagaimana reaksi berlangsung.
- Contoh lain, dalam reaksi esterifikasi, asam karboksilat bereaksi dengan alkohol untuk membentuk ester. Dalam reaksi ini, asam karboksilat bertindak sebagai donor proton (asam Brønsted-Lowry), sementara alkohol bertindak sebagai penerima proton (basa Brønsted-Lowry).
Kimia Anorganik
Teori Brønsted-Lowry juga berperan penting dalam kimia anorganik.
- Contohnya, dalam reaksi pembentukan kompleks, ion logam seringkali bertindak sebagai asam Lewis, menerima pasangan elektron dari ligan yang bertindak sebagai basa Lewis.
- Teori Brønsted-Lowry membantu kita memahami bagaimana ion logam berinteraksi dengan ligan, dan bagaimana struktur kompleks dibentuk.
- Selain itu, teori Brønsted-Lowry juga digunakan untuk menjelaskan reaksi asam-basa dalam larutan air, yang penting dalam kimia anorganik.
Pengembangan Teori Asam Basa
Teori Brønsted-Lowry memang revolusioner dalam memahami asam dan basa, tapi dunia sains nggak berhenti di situ. Ada beberapa teori lain yang muncul setelahnya, memperluas pemahaman kita tentang asam basa dan mengatasi beberapa batasan dari teori Brønsted-Lowry.
Teori Lewis
Teori Lewis, yang dikemukakan oleh Gilbert N. Lewis pada tahun 1923, menawarkan perspektif yang lebih luas tentang asam dan basa. Teori ini berfokus pada perpindahan pasangan elektron, bukan hanya perpindahan proton seperti dalam teori Brønsted-Lowry.
Menurut teori Lewis, asam adalah spesi yang dapat menerima pasangan elektron, sedangkan basa adalah spesi yang dapat mendonorkan pasangan elektron. Jadi, asam Lewis adalah penerima pasangan elektron, dan basa Lewis adalah donor pasangan elektron.
- Sebagai contoh, reaksi antara ion hidrogen (H+) dan ion hidroksida (OH-) dalam air dapat dijelaskan dengan teori Lewis. Ion hidrogen, yang kekurangan elektron, menerima pasangan elektron dari ion hidroksida, membentuk molekul air (H2O). Dalam kasus ini, ion hidrogen bertindak sebagai asam Lewis, dan ion hidroksida bertindak sebagai basa Lewis.
Teori Lewis memperluas konsep asam basa, memungkinkan kita untuk memahami reaksi-reaksi yang tidak melibatkan perpindahan proton, seperti reaksi antara boron trifluorida (BF3) dan amonia (NH3). Dalam reaksi ini, BF3, yang kekurangan elektron, menerima pasangan elektron dari NH3, membentuk ikatan koordinasi. BF3 bertindak sebagai asam Lewis, dan NH3 bertindak sebagai basa Lewis.
Teori Usanovich
Teori Usanovich, yang dikembangkan oleh Mikhail Usanovich pada tahun 1939, merupakan teori yang lebih umum dan mencakup semua jenis reaksi asam basa, termasuk reaksi yang tidak melibatkan perpindahan proton atau pasangan elektron. Teori ini mendefinisikan asam sebagai spesi yang dapat menerima anion atau mendonorkan kation, sedangkan basa sebagai spesi yang dapat mendonorkan anion atau menerima kation.
Teori Usanovich memiliki ruang lingkup yang lebih luas dibandingkan dengan teori Brønsted-Lowry dan Lewis. Teori ini dapat menjelaskan reaksi-reaksi yang melibatkan logam, oksida, dan garam, yang tidak dapat dijelaskan oleh teori Brønsted-Lowry atau Lewis.
Sebagai contoh, reaksi antara natrium (Na) dan klorin (Cl2) dapat dijelaskan dengan teori Usanovich. Natrium, yang dapat mendonorkan elektron, bertindak sebagai basa Usanovich, sedangkan klorin, yang dapat menerima elektron, bertindak sebagai asam Usanovich. Reaksi ini menghasilkan natrium klorida (NaCl), garam yang terbentuk dari kombinasi asam dan basa Usanovich.
Simpulan Akhir
Teori Brønsted-Lowry telah merevolusi pemahaman kita tentang asam dan basa, membuka jalan untuk mempelajari reaksi kimia dengan lebih detail. Dari reaksi sederhana seperti pencampuran asam cuka dengan baking soda hingga reaksi kompleks dalam tubuh manusia, teori ini memberikan dasar yang kuat untuk memahami dunia kimia yang penuh misteri.
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru