Pengertian atom menurut para ahli – Bayangkan dunia ini seperti Lego raksasa, dengan setiap batu bata mewakili partikel terkecil yang membentuk segala sesuatu: atom. Atom, si jagoan kecil yang tak kasat mata, menjadi kunci untuk memahami bagaimana alam bekerja. Dari teori atom Dalton yang sederhana hingga model atom mekanika kuantum yang rumit, para ilmuwan telah berlomba-lomba mengungkap rahasia atom.
Perjalanan memahami atom dimulai sejak abad ke-5 SM, ketika para filsuf Yunani kuno seperti Democritus mencetuskan gagasan bahwa materi terdiri dari partikel tak terbagi. Namun, baru pada abad ke-19, John Dalton mengemukakan teori atom modern yang menjadi dasar pemahaman kita tentang atom hingga saat ini.
Sejarah Konsep Atom
Atom adalah partikel terkecil dari suatu unsur yang masih memiliki sifat kimiawi unsur tersebut. Bayangkan kamu punya sepotong gula. Kamu bisa terus membaginya menjadi bagian yang lebih kecil, sampai kamu mendapatkan partikel terkecil yang tidak bisa dibagi lagi. Nah, partikel terkecil itu yang disebut atom.
Konsep atom sudah ada sejak zaman Yunani Kuno, tapi baru di abad ke-19 konsep atom mulai berkembang menjadi teori ilmiah yang lebih jelas. Nah, perjalanan panjang para ilmuwan dalam memahami atom ini punya cerita yang seru, lho! Simak penjelasan berikut!
Teori Atom Dalton
John Dalton, seorang ilmuwan Inggris, pada tahun 1803, mengajukan teori atom yang revolusioner. Teori ini menjelaskan bahwa:
- Semua materi tersusun atas partikel kecil yang disebut atom.
- Atom dari unsur yang sama memiliki sifat dan massa yang sama, sedangkan atom dari unsur berbeda memiliki sifat dan massa yang berbeda.
- Atom tidak dapat dibagi, diciptakan, atau dimusnahkan.
- Atom bergabung dalam perbandingan bilangan bulat sederhana untuk membentuk senyawa.
Teori atom Dalton menjadi dasar bagi perkembangan kimia modern. Teori ini membantu menjelaskan mengapa reaksi kimia terjadi dan bagaimana zat-zat baru terbentuk.
Model Atom Thomson
Setelah teori Dalton, J.J. Thomson, ilmuwan Inggris lainnya, melakukan percobaan dengan tabung sinar katoda dan menemukan elektron, partikel bermuatan negatif yang ada di dalam atom. Penemuan ini mengubah pemahaman tentang atom, yang sebelumnya dianggap sebagai partikel yang tak terbagi.
Thomson kemudian mengajukan model atom yang dikenal sebagai “model atom roti kismis”. Model ini menggambarkan atom sebagai bola bermuatan positif yang di dalamnya tersebar elektron bermuatan negatif seperti kismis di dalam roti.
Model atom Thomson memang lebih maju daripada model atom Dalton, tetapi masih belum sempurna. Model ini tidak dapat menjelaskan bagaimana elektron tetap berada di dalam atom dan mengapa atom memiliki struktur tertentu.
Model Atom Rutherford
Ernest Rutherford, seorang ilmuwan Selandia Baru, melakukan percobaan penghamburan sinar alfa pada lembaran tipis emas pada tahun 1911. Hasil percobaan ini menunjukkan bahwa sebagian besar sinar alfa menembus lembaran emas, tetapi sebagian kecil sinar alfa dibelokkan atau bahkan dipantulkan kembali.
Dari hasil percobaan ini, Rutherford menyimpulkan bahwa atom memiliki struktur yang tidak padat seperti yang dibayangkan Thomson, tetapi memiliki inti atom yang kecil, padat, dan bermuatan positif, yang disebut nukleus. Elektron-elektron bergerak mengelilingi inti atom seperti planet mengelilingi matahari.
Model atom Rutherford menjadi model atom yang lebih akurat daripada model sebelumnya. Model ini dapat menjelaskan fenomena penghamburan sinar alfa dan membantu memahami struktur atom yang lebih detail.
Struktur Atom
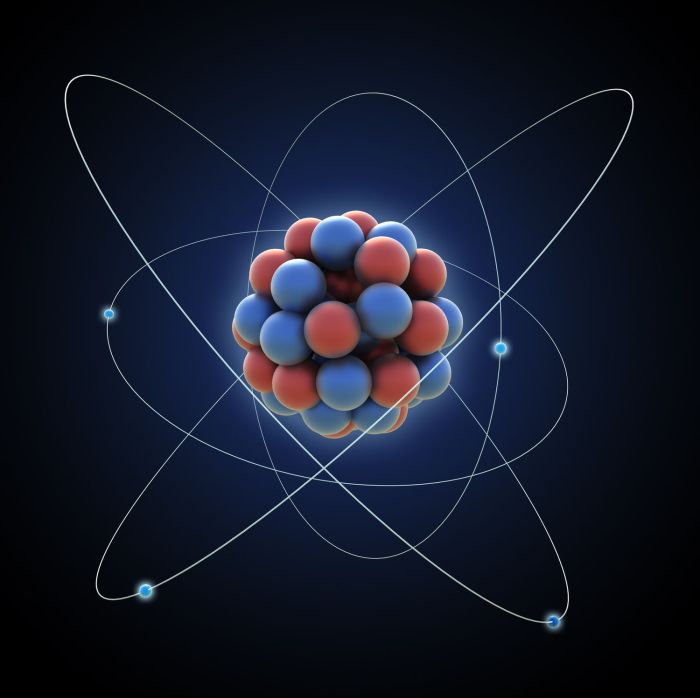
Bayangin deh, semua benda di sekitar kita, mulai dari buku, handphone, hingga tubuh kita sendiri, terbuat dari partikel-partikel super kecil yang gak kasat mata. Partikel ini disebut atom, yang merupakan unit terkecil dari suatu unsur. Nah, ternyata atom ini punya struktur internal yang menarik banget, lho! Struktur atom terdiri dari beberapa bagian utama yang punya peran penting dalam menentukan sifat-sifat suatu unsur.
Bagian-bagian Utama Atom
Atom terdiri dari tiga bagian utama, yaitu proton, neutron, dan elektron. Ketiganya punya sifat dan peran yang berbeda-beda dalam menentukan karakteristik atom. Yuk, kita bahas satu per satu!
- Proton: Proton adalah partikel bermuatan positif yang terletak di inti atom. Proton ini punya peran penting dalam menentukan nomor atom suatu unsur. Semakin banyak proton dalam atom, semakin besar nomor atomnya. Nomor atom ini menunjukkan identitas suatu unsur. Misalnya, atom hidrogen memiliki 1 proton, sedangkan atom oksigen memiliki 8 proton.
- Neutron: Neutron adalah partikel yang tidak bermuatan (netral) dan juga terletak di inti atom. Neutron punya peran penting dalam menentukan massa atom suatu unsur. Semakin banyak neutron dalam atom, semakin besar massa atomnya. Atom yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda disebut sebagai isotop.
- Elektron: Elektron adalah partikel bermuatan negatif yang bergerak mengelilingi inti atom dalam lintasan yang disebut kulit elektron. Elektron punya peran penting dalam menentukan sifat kimia suatu unsur. Jumlah elektron dalam atom biasanya sama dengan jumlah proton, sehingga atom bersifat netral.
Perbedaan Proton, Neutron, dan Elektron
Nah, agar kamu lebih mudah membedakan ketiga partikel ini, yuk kita lihat tabel perbandingannya:
| Partikel | Muatan | Massa (amu) | Lokasi |
|---|---|---|---|
| Proton | Positif (+) | 1 | Inti Atom |
| Neutron | Netral (0) | 1 | Inti Atom |
| Elektron | Negatif (-) | 1/1836 | Kulit Elektron |
Ilustrasi Struktur Atom
Bayangin deh, inti atom itu seperti matahari, sedangkan elektron-elektron yang mengelilinginya seperti planet-planet yang mengitari matahari. Proton dan neutron yang berada di inti atom membentuk inti atom yang padat dan bermuatan positif. Sementara elektron yang bermuatan negatif bergerak mengelilingi inti atom dalam lintasan-lintasan tertentu yang disebut kulit elektron. Kulit elektron ini memiliki tingkat energi yang berbeda-beda, dengan kulit elektron yang lebih dekat ke inti atom memiliki energi yang lebih rendah.
Bayangin atom, unit terkecil dari suatu unsur yang gak bisa dibagi lagi. Sama kayak atom, mobilitas sosial juga punya definisi yang beragam. Pengertian mobilitas sosial menurut para ahli menjelaskan pergerakan individu atau kelompok dalam struktur sosial, bisa naik, turun, atau horizontal.
Nah, mirip kayak atom yang punya sub-partikel, mobilitas sosial juga punya faktor-faktor yang memengaruhi pergerakannya, misalnya pendidikan, ekonomi, dan politik.
Model Atom Bohr
Setelah model atom Rutherford yang menggambarkan atom sebagai inti positif yang dikelilingi elektron negatif, Niels Bohr muncul dengan model atomnya sendiri. Model ini menawarkan penjelasan yang lebih rinci tentang bagaimana elektron bergerak di sekitar inti atom. Nah, penasaran kan bagaimana model atom Bohr ini bekerja?
Model Atom Bohr
Model atom Bohr menyatakan bahwa elektron bergerak dalam orbit melingkar yang terkuantisasi di sekitar inti atom. Maksudnya, elektron hanya dapat berada pada orbit dengan tingkat energi tertentu, dan tidak boleh berada di antara orbit-orbit tersebut. Orbit-orbit ini seperti “jalur” yang telah ditentukan, yang disebut kulit elektron. Semakin jauh kulit elektron dari inti, semakin tinggi tingkat energinya.
Model Bohr juga menjelaskan bahwa elektron dapat berpindah dari satu kulit ke kulit lainnya dengan menyerap atau memancarkan energi. Ketika elektron menyerap energi, ia akan berpindah ke kulit yang lebih tinggi. Sebaliknya, ketika elektron melepaskan energi, ia akan berpindah ke kulit yang lebih rendah. Proses ini menghasilkan spektrum emisi atom, yang merupakan kumpulan garis-garis cahaya yang dipancarkan oleh atom ketika elektron berpindah dari tingkat energi yang lebih tinggi ke tingkat energi yang lebih rendah.
Model atom Bohr berhasil menjelaskan spektrum emisi atom hidrogen, yang merupakan atom paling sederhana. Atom hidrogen hanya memiliki satu proton dan satu elektron. Ketika atom hidrogen menyerap energi, elektronnya akan tereksitasi ke tingkat energi yang lebih tinggi. Kemudian, ketika elektron kembali ke tingkat energi dasarnya, ia akan memancarkan energi dalam bentuk cahaya. Energi cahaya yang dipancarkan akan memiliki panjang gelombang tertentu, yang sesuai dengan perbedaan energi antara tingkat energi awal dan akhir elektron.
Model atom Bohr mampu memprediksi panjang gelombang garis-garis spektrum emisi atom hidrogen dengan akurat. Hal ini merupakan bukti keberhasilan model Bohr dalam menjelaskan perilaku atom hidrogen.
Ilustrasi Model Atom Bohr
Bayangkan sebuah planet yang mengorbit matahari. Planet ini hanya dapat bergerak pada orbit tertentu, dan tidak boleh berada di antara orbit-orbit tersebut. Begitu juga dengan elektron dalam model atom Bohr. Elektron hanya dapat berada pada orbit tertentu, dan tidak boleh berada di antara orbit-orbit tersebut.
Ilustrasi model atom Bohr menunjukkan elektron yang bergerak dalam orbit tertentu di sekitar inti atom. Orbit-orbit ini memiliki tingkat energi yang berbeda, dan elektron dapat berpindah dari satu orbit ke orbit lainnya dengan menyerap atau memancarkan energi.
Keterbatasan Model Atom Bohr
Meskipun model atom Bohr berhasil menjelaskan spektrum emisi atom hidrogen, model ini memiliki beberapa keterbatasan. Berikut beberapa keterbatasannya:
- Model atom Bohr hanya dapat menjelaskan spektrum emisi atom hidrogen, dan tidak dapat menjelaskan spektrum emisi atom yang lebih kompleks.
- Model atom Bohr tidak dapat menjelaskan mengapa elektron tidak jatuh ke inti atom karena gaya tarik elektrostatis.
- Model atom Bohr tidak dapat menjelaskan efek magnetik atom.
Karena keterbatasan ini, model atom Bohr akhirnya digantikan oleh model atom mekanika kuantum. Model atom mekanika kuantum lebih akurat dan mampu menjelaskan perilaku atom yang lebih kompleks.
Atom dan Reaksi Kimia
Bayangin kamu lagi masak mie instan. Kamu ngeluarin mie, bumbu, dan air. Terus kamu campur semuanya dalam panci, terus dipanasin. Tada! Mie instan siap disantap. Tapi tau gak sih, di balik proses sederhana itu, ada jutaan atom yang lagi beraksi!
Reaksi kimia itu sebenarnya proses perubahan susunan atom. Atom-atom ini kayak LEGO, mereka bisa dipisahkan, digabung, atau diubah susunannya untuk membentuk zat baru. Jadi, mie instan yang kamu makan itu adalah hasil dari reaksi kimia yang melibatkan atom-atom dari mie, bumbu, dan air.
Reaksi Kimia Sederhana
Oke, kita bahas reaksi kimia sederhana, misal reaksi antara logam magnesium (Mg) dengan asam klorida (HCl). Ketika kamu campur keduanya, akan terjadi reaksi yang menghasilkan garam magnesium klorida (MgCl2) dan gas hidrogen (H2).
Mg + 2HCl → MgCl2 + H2
Dalam reaksi ini, atom magnesium (Mg) bereaksi dengan atom hidrogen (H) dan klorin (Cl) dari asam klorida. Atom-atom magnesium dan klorin membentuk ikatan baru untuk menghasilkan garam magnesium klorida, sementara atom-atom hidrogen bergabung membentuk gas hidrogen.
Peran Atom dalam Sifat Kimia
Konsep atom sangat penting dalam memahami sifat kimia suatu zat. Sifat kimia itu kayak kepribadian dari suatu zat, yang menunjukkan bagaimana zat tersebut bereaksi dengan zat lain. Contohnya, emas (Au) dikenal sebagai logam yang tidak reaktif. Ini karena atom emas punya struktur elektron yang stabil dan sulit untuk diubah.
Sebaliknya, natrium (Na) sangat reaktif. Ini karena atom natrium punya satu elektron valensi yang mudah dilepas, sehingga mudah bereaksi dengan zat lain.
Jadi, dengan memahami susunan atom dan bagaimana mereka berinteraksi, kita bisa memprediksi sifat kimia suatu zat dan bagaimana zat tersebut akan bereaksi dengan zat lain.
Penutupan: Pengertian Atom Menurut Para Ahli
Atom, si jagoan kecil yang tak kasat mata, telah membuka pintu menuju pemahaman yang lebih dalam tentang alam semesta. Dari struktur atom yang kompleks hingga perannya dalam reaksi kimia, atom terus memikat para ilmuwan untuk mengungkap misteri-misteri yang tersembunyi di dalamnya.
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru