Pernah dengar istilah asam? Ya, asam itu bukan cuma sekedar rasa masam yang kamu rasakan di jeruk nipis atau cuka. Asam ternyata punya peran penting dalam kehidupan kita, lho! Mulai dari industri kimia, makanan, bahkan tubuh kita sendiri! Tapi, apa sih sebenarnya asam itu? Simak penjelasan lengkap tentang pengertian asam menurut Arrhenius, teorinya, dan contohnya di sini.
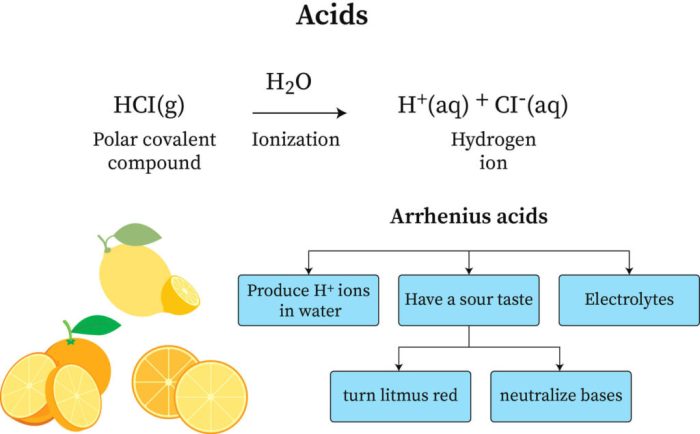
Dalam dunia kimia, asam didefinisikan sebagai senyawa yang melepaskan ion hidrogen (H+) ketika dilarutkan dalam air. Definisi ini dikemukakan oleh ilmuwan bernama Svante Arrhenius pada tahun 1884, dan dikenal sebagai teori asam-basa Arrhenius. Teori ini menjadi dasar pemahaman kita tentang sifat asam dan bagaimana asam berinteraksi dengan zat lain.
Pengertian Asam Menurut Arrhenius
Pernahkah kamu merasakan sensasi asam di lidah saat mencicipi jeruk nipis atau cuka? Rasa asam yang khas ini ternyata memiliki penjelasan ilmiah, lho! Dalam ilmu kimia, asam didefinisikan sebagai zat yang dapat melepaskan ion hidrogen (H+) ketika dilarutkan dalam air. Namun, definisi ini hanya berlaku untuk asam Arrhenius, salah satu teori asam-basa yang diajukan oleh ilmuwan Swedia bernama Svante Arrhenius pada tahun 1884.
Teori Asam-Basa Arrhenius
Teori Arrhenius memberikan gambaran tentang bagaimana asam dan basa bekerja dalam larutan air. Menurut teori ini, asam adalah zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air, sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) ketika dilarutkan dalam air.
Sederhananya, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. Nah, bayangkan industri, yang didefinisikan sebagai aktivitas produksi barang dan jasa secara besar-besaran, pengertian industri menurut para ahli ini juga bisa melibatkan proses kimia. Beberapa industri, seperti industri kimia, memanfaatkan reaksi asam-basa untuk menghasilkan produk.
Jadi, konsep asam menurut Arrhenius punya peran penting dalam dunia industri juga, lho!
Contohnya, asam klorida (HCl) adalah asam Arrhenius karena ketika dilarutkan dalam air, ia akan terionisasi menjadi ion hidrogen (H+) dan ion klorida (Cl-):
HCl(aq) → H+(aq) + Cl-(aq)
Begitu pula dengan natrium hidroksida (NaOH) yang merupakan basa Arrhenius karena ketika dilarutkan dalam air, ia akan terionisasi menjadi ion natrium (Na+) dan ion hidroksida (OH-):
NaOH(aq) → Na+(aq) + OH-(aq)
Contoh Asam dalam Kehidupan Sehari-hari
Asam sering dijumpai dalam kehidupan sehari-hari, baik dalam bentuk alami maupun buatan. Berikut beberapa contohnya:
- Jeruk nipis dan lemon mengandung asam sitrat, yang memberikan rasa asam yang khas.
- Cuka mengandung asam asetat, yang memberikan rasa asam dan aroma khas.
- Yogurt mengandung asam laktat, yang dihasilkan dari fermentasi susu.
- Jus buah mengandung asam organik, seperti asam malat dan asam tartarat.
- Asam lambung membantu mencerna makanan dalam sistem pencernaan.
Contoh Soal dan Pembahasan
Setelah memahami definisi asam menurut Arrhenius, sekarang saatnya kita latihan dengan contoh soal. Soal-soal ini akan membantu kamu memahami konsep asam dan bagaimana penerapannya dalam reaksi kimia.
Berikut adalah contoh soal yang bisa kamu coba:
Larutan HCl dalam air bersifat asam. Jelaskan mengapa larutan HCl bersifat asam menurut teori Arrhenius.
Untuk menjawab soal ini, kita perlu mengingat definisi asam menurut Arrhenius. Teori Arrhenius menyatakan bahwa asam adalah zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. Sekarang, mari kita lihat bagaimana HCl memenuhi definisi ini.
- Ketika HCl dilarutkan dalam air, ia akan terionisasi menjadi ion hidrogen (H+) dan ion klorida (Cl-).
- Reaksi ionisasi HCl dalam air dapat ditulis sebagai berikut:
HCl (aq) → H+ (aq) + Cl- (aq)
Karena HCl menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air, maka ia diklasifikasikan sebagai asam menurut teori Arrhenius.
Contoh Soal 2
Berikut adalah contoh soal lainnya:
Manakah dari zat berikut yang merupakan asam menurut teori Arrhenius?
a. NaOH
b. HNO3
c. NH3
d. CH3COOH
Untuk menjawab soal ini, kita perlu memeriksa setiap zat dan melihat apakah ia menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air.
- NaOH (natrium hidroksida) adalah basa, bukan asam. Ketika dilarutkan dalam air, NaOH menghasilkan ion hidroksida (OH-), bukan ion hidrogen (H+).
- HNO3 (asam nitrat) adalah asam. Ketika dilarutkan dalam air, HNO3 terionisasi menjadi ion hidrogen (H+) dan ion nitrat (NO3-).
- NH3 (amonia) adalah basa. Ketika dilarutkan dalam air, NH3 bereaksi dengan air untuk membentuk ion amonium (NH4+) dan ion hidroksida (OH-).
- CH3COOH (asam asetat) adalah asam. Ketika dilarutkan dalam air, CH3COOH terionisasi menjadi ion hidrogen (H+) dan ion asetat (CH3COO-).
Jadi, jawaban yang benar adalah b dan d. HNO3 dan CH3COOH adalah asam menurut teori Arrhenius karena menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air.
Penutup: Pengertian Asam Menurut Arrhenius
Jadi, asam Arrhenius adalah senyawa yang melepaskan ion hidrogen (H+) ketika dilarutkan dalam air. Teori ini membantu kita memahami sifat asam dan bagaimana asam bereaksi dengan zat lain. Mulai dari cuka yang kamu gunakan untuk memasak, hingga obat-obatan yang kamu konsumsi, asam Arrhenius berperan penting dalam kehidupan kita.
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru