Jelaskan pengertian asam dan basa menurut arrhenius – Pernah bertanya-tanya kenapa minuman soda bikin kamu sendawa? Atau gimana sabun bisa bersihin tangan kamu? Jawabannya ada di dunia asam dan basa! Teori Arrhenius, yang ditemukan oleh ilmuwan Swedia bernama Svante Arrhenius, memberikan penjelasan sederhana tentang sifat asam dan basa. Siap-siap ngerti asam dan basa, yuk!
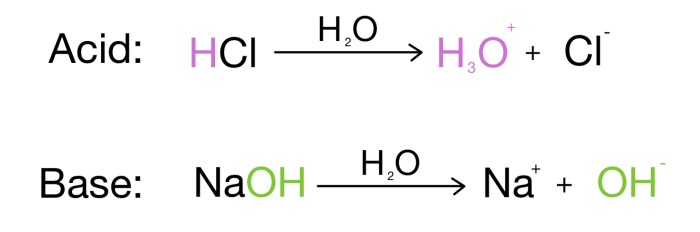
Teori Arrhenius menjelaskan bahwa asam adalah zat yang menghasilkan ion hidrogen (H+) saat dilarutkan dalam air. Contohnya, asam klorida (HCl) dalam air akan terurai menjadi ion hidrogen (H+) dan ion klorida (Cl-). Sementara itu, basa adalah zat yang menghasilkan ion hidroksida (OH-) saat dilarutkan dalam air. Contohnya, natrium hidroksida (NaOH) dalam air akan terurai menjadi ion natrium (Na+) dan ion hidroksida (OH-).
Pengertian Asam dan Basa Menurut Arrhenius
Kamu pasti pernah mendengar istilah asam dan basa, kan? Kedua istilah ini seringkali muncul dalam pelajaran kimia di sekolah. Tapi, pernahkah kamu bertanya-tanya apa sebenarnya definisi asam dan basa? Nah, salah satu teori yang menjelaskan pengertian asam dan basa adalah teori Arrhenius. Teori ini dikemukakan oleh Svante Arrhenius, seorang ilmuwan Swedia, pada tahun 1884.
Secara umum, asam dan basa memiliki sifat yang berlawanan. Asam memiliki rasa masam dan dapat mengubah warna lakmus menjadi merah, sedangkan basa memiliki rasa pahit dan dapat mengubah warna lakmus menjadi biru. Selain itu, asam dan basa juga dapat bereaksi membentuk garam dan air. Tapi, itu baru gambaran umum. Untuk memahami lebih dalam, mari kita bahas teori Arrhenius tentang asam dan basa.
Teori Arrhenius tentang Asam
Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. Ion hidrogen ini yang menyebabkan larutan asam memiliki sifat masam dan dapat mengubah warna lakmus menjadi merah.
- Contoh asam menurut Arrhenius: asam klorida (HCl), asam sulfat (H2SO4), asam nitrat (HNO3), dan asam asetat (CH3COOH).
Teori Arrhenius tentang Basa
Berbeda dengan asam, basa menurut Arrhenius adalah zat yang menghasilkan ion hidroksida (OH-) ketika dilarutkan dalam air. Ion hidroksida ini yang menyebabkan larutan basa memiliki sifat pahit dan dapat mengubah warna lakmus menjadi biru.
- Contoh basa menurut Arrhenius: natrium hidroksida (NaOH), kalium hidroksida (KOH), kalsium hidroksida (Ca(OH)2), dan amonia (NH3).
Contoh Asam dan Basa dalam Kehidupan Sehari-hari
Asam dan basa bukan hanya istilah kimia yang rumit, lho. Kamu bisa menemukannya dalam kehidupan sehari-hari. Contohnya, jeruk nipis mengandung asam sitrat, cuka mengandung asam asetat, dan sabun mengandung basa.
- Asam sitrat dalam jeruk nipis dapat digunakan untuk membersihkan noda dan mencerahkan kulit.
- Asam asetat dalam cuka dapat digunakan untuk membersihkan peralatan dapur dan menghilangkan bau.
- Basa dalam sabun dapat digunakan untuk membersihkan kotoran dan lemak.
Kekurangan Teori Arrhenius
Meskipun teori Arrhenius memberikan penjelasan yang baik tentang asam dan basa, teori ini memiliki beberapa kekurangan. Salah satunya adalah teori ini hanya berlaku untuk larutan dalam air. Selain itu, teori Arrhenius tidak dapat menjelaskan sifat asam dan basa dari zat yang tidak mengandung ion hidrogen atau ion hidroksida.
Teori Arrhenius
Kamu pasti pernah dengar istilah asam dan basa, kan? Dua istilah ini sering muncul dalam pelajaran kimia, terutama di topik larutan. Nah, salah satu teori yang menjelaskan sifat asam dan basa adalah teori Arrhenius. Teori ini dikemukakan oleh seorang ilmuwan bernama Svante Arrhenius pada tahun 1884. Teori ini memberikan penjelasan sederhana tentang bagaimana asam dan basa bekerja dan memberikan dasar bagi pemahaman kita tentang kimia larutan.
Pengertian Asam dan Basa Menurut Arrhenius
Teori Arrhenius menyatakan bahwa asam adalah zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. Sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) ketika dilarutkan dalam air. Sederhananya, asam dan basa adalah zat yang menghasilkan ion tertentu ketika dilarutkan dalam air.
Asam + Air → Ion Hidrogen (H+) + Anion
Basa + Air → Ion Hidroksida (OH-) + Kation
Perbedaan Asam dan Basa Menurut Arrhenius
Untuk lebih jelasnya, berikut tabel yang membandingkan definisi asam dan basa menurut Arrhenius beserta contohnya:
| Sifat | Asam | Basa |
|---|---|---|
| Definisi | Zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air | Zat yang menghasilkan ion hidroksida (OH-) ketika dilarutkan dalam air |
| Contoh | Asam klorida (HCl), Asam sulfat (H2SO4), Asam nitrat (HNO3) | Natrium hidroksida (NaOH), Kalium hidroksida (KOH), Kalsium hidroksida (Ca(OH)2) |
| Rasa | Asam memiliki rasa masam | Basa memiliki rasa pahit dan licin |
| Sifat terhadap kertas lakmus | Asam mengubah warna kertas lakmus biru menjadi merah | Basa mengubah warna kertas lakmus merah menjadi biru |
| Reaksi dengan logam | Asam bereaksi dengan logam menghasilkan gas hidrogen (H2) | Basa tidak bereaksi dengan logam |
Sifat Asam
Setelah memahami definisi asam menurut Arrhenius, kita akan menggali lebih dalam tentang sifat-sifatnya. Asam, seperti lemon yang asam atau cuka yang tajam, memiliki karakteristik unik yang membedakannya dari zat lain. Mari kita telusuri sifat-sifat asam dan bagaimana mereka berinteraksi dengan dunia di sekitar kita.
Sifat-sifat Asam
Asam memiliki sifat khas yang membedakannya dari zat lain. Sifat-sifat ini menjadikan asam penting dalam berbagai aspek kehidupan, mulai dari proses kimia di dalam tubuh kita hingga industri kimia.
- Rasa Asam: Asam memiliki rasa asam yang khas, seperti yang kamu rasakan saat menggigit lemon atau jeruk nipis. Rasa asam ini merupakan ciri khas dari asam, namun hati-hati, jangan pernah mencicipi asam yang tidak dikenal karena bisa berbahaya.
- Bereaksi dengan Basa: Asam dan basa merupakan pasangan yang saling melengkapi. Ketika asam bereaksi dengan basa, mereka saling menetralkan, membentuk garam dan air. Reaksi ini dikenal sebagai reaksi netralisasi. Misalnya, asam klorida (HCl) bereaksi dengan natrium hidroksida (NaOH) menghasilkan garam natrium klorida (NaCl) dan air (H2O).
HCl + NaOH → NaCl + H2O
- Mengubah Warna Indikator: Asam dapat mengubah warna indikator, yaitu zat yang berubah warna ketika berada dalam larutan asam atau basa. Indikator yang umum digunakan adalah kertas lakmus. Kertas lakmus berwarna biru akan berubah menjadi merah ketika dicelupkan ke dalam larutan asam, sedangkan kertas lakmus berwarna merah akan tetap merah.
Contoh Reaksi Asam dengan Basa
Reaksi antara asam dan basa adalah salah satu reaksi kimia yang paling penting. Reaksi ini menghasilkan garam dan air, dan sering kali digunakan dalam berbagai aplikasi, seperti pembuatan sabun dan pupuk.
Sebagai contoh, ketika asam klorida (HCl) bereaksi dengan natrium hidroksida (NaOH), mereka akan menghasilkan garam natrium klorida (NaCl) dan air (H2O). Reaksi ini dapat dituliskan sebagai berikut:
HCl + NaOH → NaCl + H2O
Dalam reaksi ini, asam klorida (HCl) memberikan ion hidrogen (H+) kepada natrium hidroksida (NaOH), membentuk ion klorida (Cl-) dan ion natrium (Na+). Ion-ion ini kemudian bergabung membentuk garam natrium klorida (NaCl), sementara ion hidrogen (H+) dan ion hidroksida (OH-) bergabung membentuk air (H2O).
Asam dan Warna Indikator
Asam memiliki kemampuan untuk mengubah warna indikator, yaitu zat yang berubah warna ketika berada dalam larutan asam atau basa. Indikator yang umum digunakan adalah kertas lakmus.
Ketika kertas lakmus biru dicelupkan ke dalam larutan asam, kertas lakmus akan berubah warna menjadi merah. Hal ini karena asam melepaskan ion hidrogen (H+) yang bereaksi dengan indikator, mengubah strukturnya dan menyebabkan perubahan warna. Sebaliknya, kertas lakmus merah akan tetap merah dalam larutan asam karena strukturnya sudah sesuai dengan kondisi asam.
Perubahan warna ini menunjukkan bahwa asam memiliki sifat khas yang dapat dideteksi dengan menggunakan indikator.
Sifat Basa
Oke, kalau asam udah dibahas, sekarang kita bahas tentang sifat basa. Basa itu kayak pahlawannya asam, selalu ada untuk netralisir si asam. Nah, gimana sih sifat-sifat basa ini? Yuk, kita bahas satu-satu!
Sifat-Sifat Basa
Basa punya beberapa sifat yang membedakannya dari asam. Berikut adalah beberapa sifat yang bisa kamu ingat:
- Rasa pahit: Kalau asam rasanya masam, basa punya rasa pahit. Coba deh kamu cicip sedikit sabun, pasti pahit kan? Tapi jangan sampai ditelan ya, bahaya!
- Tekstur licin: Basa juga terkenal dengan teksturnya yang licin. Contohnya, sabun yang kita gunakan untuk mandi. Nah, sabun ini mengandung basa yang membuat teksturnya jadi licin.
- Bersifat korosif: Basa juga bisa merusak beberapa material, sama kayak asam. Coba deh kamu lihat apa yang terjadi kalau basa tumpah di kulit, pasti perih dan bisa menyebabkan iritasi. Hati-hati ya!
- Dapat menetralisir asam: Ini nih yang paling penting. Basa bisa bereaksi dengan asam dan menghasilkan garam dan air. Reaksi ini disebut reaksi netralisasi. Misalnya, kalau kamu mencampur larutan asam cuka dengan larutan basa seperti soda kue, maka akan terjadi reaksi netralisasi yang menghasilkan garam dan air.
Seperti yang udah dijelasin sebelumnya, basa bisa bereaksi dengan asam dalam reaksi netralisasi. Reaksi ini menghasilkan garam dan air. Contohnya, kalau kamu mencampur larutan asam klorida (HCl) dengan larutan basa natrium hidroksida (NaOH), maka akan terjadi reaksi netralisasi yang menghasilkan garam natrium klorida (NaCl) dan air (H2O):
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Reaksi netralisasi ini penting banget dalam kehidupan sehari-hari. Misalnya, dalam proses pencernaan, asam lambung yang berlebihan bisa dinetralisir oleh basa yang dihasilkan pankreas.
Basa dan Indikator
Basa juga bisa mengubah warna indikator. Indikator adalah zat yang bisa berubah warna ketika berada dalam larutan asam atau basa. Contohnya, kertas lakmus yang berwarna biru akan berubah menjadi merah ketika dicelupkan ke dalam larutan asam, dan tetap berwarna biru ketika dicelupkan ke dalam larutan basa.
- Kertas lakmus: Kertas lakmus adalah salah satu contoh indikator yang umum digunakan. Kertas lakmus biru akan berubah menjadi merah dalam larutan asam, dan tetap berwarna biru dalam larutan basa.
- Fenolftalein: Indikator ini tidak berwarna dalam larutan asam, tetapi akan berubah menjadi merah muda dalam larutan basa.
- Metil jingga: Indikator ini berwarna merah dalam larutan asam, tetapi akan berubah menjadi kuning dalam larutan basa.
Nah, itulah beberapa sifat basa yang perlu kamu tahu. Basa itu penting banget dalam kehidupan kita, baik dalam proses industri maupun dalam tubuh kita sendiri. Jadi, jangan lupa untuk selalu berhati-hati dalam menggunakan basa, ya!
Aplikasi Asam dan Basa
Nah, setelah kamu tahu pengertian asam dan basa menurut Arrhenius, sekarang saatnya kita bahas apa sih aplikasi kerennya di dunia nyata? Asam dan basa ternyata punya peran penting dalam berbagai bidang, lho, mulai dari makanan yang kamu makan, obat-obatan yang kamu minum, sampai industri yang menghasilkan barang-barang yang kamu pakai sehari-hari. Siap-siap tercengang!
Makanan
Asam dan basa punya peran penting dalam menciptakan rasa dan tekstur makanan yang kamu sukai. Kamu pasti pernah merasakan asam dari jeruk nipis dalam minuman, atau rasa asam dari cuka yang digunakan untuk membuat acar. Nah, itu semua karena adanya asam sitrat dan asam asetat.
- Asam sitrat, misalnya, ditemukan dalam buah jeruk, lemon, dan juga digunakan sebagai pengawet makanan.
- Asam asetat dalam cuka membantu mengawetkan makanan dan memberikan rasa asam yang khas.
- Basa seperti natrium bikarbonat (baking soda) juga penting dalam membuat kue mengembang.
Farmasi
Asam dan basa juga punya peran penting dalam dunia farmasi, lho! Mereka digunakan dalam pembuatan obat-obatan, membantu mempertahankan stabilitas obat, dan membantu tubuh menyerap obat dengan lebih baik.
- Contohnya, asam asetilsalisilat (aspirin) merupakan asam yang digunakan sebagai obat pereda nyeri dan penurun panas.
- Basa seperti natrium hidroksida digunakan dalam pembuatan sabun dan detergen.
Industri
Asam dan basa juga punya peran penting dalam berbagai industri. Bayangkan, asam sulfat yang merupakan asam kuat, digunakan dalam pembuatan pupuk, baterai, dan detergen.
Oke, jadi menurut Arrhenius, asam itu senyawa yang kalau dilarutkan dalam air, dia bakal ngeluarin ion hidrogen (H+). Nah, kalau basa, dia ngeluarin ion hidroksida (OH-) pas dilarutkan. Coba bayangin, kayak kota gitu. Menurut pengertian kota menurut Bintarto , kota itu daerah yang penduduknya padat, ada berbagai macam kegiatan ekonomi, dan punya pemerintahan sendiri.
Sama kayak asam basa, kota juga punya ciri khas masing-masing yang membedakannya dari yang lain. Nah, asam dan basa juga punya ciri khas masing-masing, dan bisa dibedain berdasarkan apa yang dia keluarkan saat dilarutkan dalam air.
- Asam klorida (HCl) digunakan dalam pembuatan plastik, karet, dan juga dalam proses pengolahan logam.
- Basa seperti natrium hidroksida digunakan dalam pembuatan sabun, kertas, dan juga dalam proses pengolahan air limbah.
Reaksi Kimia dan Proses Biologis
Asam dan basa punya peran yang sangat penting dalam reaksi kimia dan proses biologis. Mereka berperan dalam berbagai reaksi, seperti:
- Reaksi netralisasi: Asam dan basa bereaksi membentuk garam dan air, yang menghasilkan panas.
- Reaksi asam-basa dalam tubuh: Asam dan basa membantu menjaga pH tubuh agar tetap stabil.
Contohnya, asam lambung (HCl) berperan dalam mencerna makanan, sedangkan basa seperti natrium bikarbonat berperan dalam menetralkan asam lambung agar tidak terlalu asam.
Kekuatan Asam dan Basa
Oke, kita sudah bahas tentang asam dan basa menurut Arrhenius. Sekarang, mari kita bahas lebih dalam tentang kekuatan asam dan basa. Singkatnya, kekuatan asam dan basa menunjukkan seberapa besar mereka bisa terionisasi dalam larutan. Makin kuat asam atau basa, makin banyak ion yang mereka hasilkan.
Kekuatan Asam
Asam kuat adalah asam yang terionisasi sepenuhnya dalam larutan. Artinya, semua molekul asam akan terpecah menjadi ion hidrogen (H+) dan ion negatif. Contohnya, asam klorida (HCl) adalah asam kuat, yang akan terionisasi sepenuhnya dalam air menjadi ion hidrogen (H+) dan ion klorida (Cl-).
Asam lemah, di sisi lain, hanya terionisasi sebagian dalam larutan. Hanya sebagian kecil molekul asam yang terpecah menjadi ion hidrogen (H+) dan ion negatif. Contohnya, asam asetat (CH3COOH) adalah asam lemah, yang hanya terionisasi sebagian dalam air menjadi ion hidrogen (H+) dan ion asetat (CH3COO-).
Kekuatan Basa
Basa kuat adalah basa yang terionisasi sepenuhnya dalam larutan. Artinya, semua molekul basa akan terpecah menjadi ion hidroksida (OH-) dan ion positif. Contohnya, natrium hidroksida (NaOH) adalah basa kuat, yang akan terionisasi sepenuhnya dalam air menjadi ion hidroksida (OH-) dan ion natrium (Na+).
Basa lemah, di sisi lain, hanya terionisasi sebagian dalam larutan. Hanya sebagian kecil molekul basa yang terpecah menjadi ion hidroksida (OH-) dan ion positif. Contohnya, amonia (NH3) adalah basa lemah, yang hanya terionisasi sebagian dalam air menjadi ion hidroksida (OH-) dan ion amonium (NH4+).
Skala pH
Skala pH adalah skala yang digunakan untuk mengukur keasaman atau kebasaan suatu larutan. Skala pH berkisar dari 0 hingga 14, dengan 7 sebagai titik netral. Larutan dengan pH kurang dari 7 bersifat asam, sedangkan larutan dengan pH lebih dari 7 bersifat basa.
| pH | Klasifikasi |
|---|---|
| 0-2 | Asam Kuat |
| 3-5 | Asam Lemah |
| 6 | Asam Lemah |
| 7 | Netral |
| 8 | Basa Lemah |
| 9-11 | Basa Lemah |
| 12-14 | Basa Kuat |
Kelebihan dan Kekurangan Teori Arrhenius: Jelaskan Pengertian Asam Dan Basa Menurut Arrhenius
Teori Arrhenius tentang asam dan basa adalah teori yang mendasari pemahaman kita tentang reaksi kimia dalam larutan air. Teori ini memberikan penjelasan sederhana tentang sifat asam dan basa, tetapi juga memiliki beberapa kelemahan. Mari kita bahas lebih lanjut tentang kelebihan dan kekurangan dari teori Arrhenius.
Kelebihan Teori Arrhenius
Teori Arrhenius memiliki beberapa kelebihan yang membuatnya penting dalam kimia:
- Mudah dipahami dan diterapkan: Teori ini mudah dipahami dan diterapkan, bahkan bagi pemula dalam kimia. Definisi sederhana tentang asam sebagai donor proton dan basa sebagai penerima proton membuat konsep ini mudah diingat dan digunakan dalam perhitungan kimia.
- Menjelaskan banyak reaksi kimia: Teori Arrhenius dapat menjelaskan banyak reaksi kimia yang terjadi dalam larutan air, seperti reaksi netralisasi antara asam dan basa.
- Berbasis eksperimen: Teori Arrhenius didasarkan pada pengamatan eksperimental, yang memberikan dasar kuat untuk teori tersebut.
Kekurangan Teori Arrhenius
Meskipun memiliki kelebihan, teori Arrhenius juga memiliki beberapa kekurangan:
- Hanya berlaku untuk larutan air: Teori Arrhenius hanya berlaku untuk reaksi kimia yang terjadi dalam larutan air. Ia tidak dapat menjelaskan sifat asam dan basa dalam pelarut non-air.
- Tidak dapat menjelaskan semua jenis asam dan basa: Teori Arrhenius tidak dapat menjelaskan semua jenis asam dan basa, seperti asam Lewis dan basa Lewis. Misalnya, amonia (NH3) dapat bertindak sebagai basa dalam reaksi kimia, tetapi tidak menghasilkan ion hidroksida (OH-) dalam larutan air.
- Tidak menjelaskan kekuatan asam dan basa: Teori Arrhenius tidak menjelaskan mengapa beberapa asam lebih kuat daripada yang lain, atau mengapa beberapa basa lebih kuat daripada yang lain.
Perbandingan Teori Arrhenius dengan Teori Asam dan Basa Lainnya
Teori Arrhenius adalah teori pertama yang menjelaskan sifat asam dan basa, tetapi ia memiliki keterbatasan. Seiring waktu, teori asam dan basa lainnya muncul, seperti teori Brønsted-Lowry dan teori Lewis, yang memberikan pemahaman yang lebih komprehensif tentang sifat asam dan basa.
- Teori Brønsted-Lowry: Teori ini memperluas definisi asam dan basa dengan mempertimbangkan transfer proton dalam reaksi kimia. Asam didefinisikan sebagai donor proton, sedangkan basa didefinisikan sebagai penerima proton. Teori ini lebih umum daripada teori Arrhenius karena dapat menjelaskan reaksi asam-basa dalam pelarut non-air.
- Teori Lewis: Teori ini mendefinisikan asam sebagai penerima pasangan elektron, sedangkan basa didefinisikan sebagai donor pasangan elektron. Teori ini lebih luas lagi daripada teori Brønsted-Lowry karena dapat menjelaskan reaksi asam-basa yang tidak melibatkan transfer proton.
Simpulan Akhir
Teori Arrhenius, meskipun sederhana, membuka pintu pemahaman kita tentang asam dan basa. Walaupun teori ini memiliki kekurangan, konsep dasar tentang ion hidrogen dan hidroksida tetap menjadi pondasi penting dalam kimia. Jadi, sekarang kamu sudah tahu kan, kenapa soda bikin sendawa dan sabun bisa bersihin tangan?
 StempelExpress Informasi Edukasi Terbaru
StempelExpress Informasi Edukasi Terbaru